
【题目】图为用惰性电极电解制备高锰酸钾的装置示意图如下。下列说法正确的是
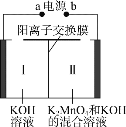
A.a为电源正极
B.Ⅰ中的K+通过阳离子交换膜移向Ⅱ
C.若不使用离子交换膜,KMnO4的产率可能会降低
D.若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: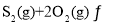
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
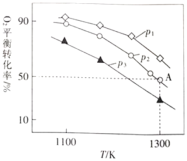
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)可用于冶金、电镀等行业,其制备的一种工艺流程如下:
I.溶解:取海绵铜(主要含Cu和CuO),加入稀硫酸和NH4NO3的混合溶液,控制溶液温度在60~70℃,不断搅拌至固体全部溶解,得蓝色溶液(过程中无气体产生);
II.转化:向蓝色溶液中加入(NH4)2SO3和NH4Cl,充分反应后过滤,得到CuCl粗品;
III.洗涤:CuCl粗品依次用pH=2硫酸和乙醇洗涤,烘干后得到CuCl产品。
(资料)CuCl固体难溶于水,与Cl-反应生成可溶于水的络离子[CuCl2]-;潮湿的CuCl固体露置于空气容易被氧化。
(1)过程I中:
①本工艺中促进海绵铜溶解的措施有________。
②氧化铜溶解的离子方程式是________。
③充分反应后NH4+的浓度约为反应前的2倍,原因是________。
(2)过程II中:
①(NH4)2SO3的作用是_________。
②NH4Cl的用量对铜的沉淀率的影响如下图所示。
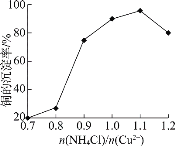
n(NH4Cl)/n(Cu2+)![]() 1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
(3)过程III中,用乙醇洗涤的目的是________。
(4)产品纯度测定:量取CuCl产品a g于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000 mol/L KMnO4标准溶液滴定Fe2+,消耗KMnO4溶液b mL。(本实验中的MnO4-被还原为Mn2+,不与产品中杂质和Cl-反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是_________。
②产品中CuCl(摩尔质量为99g/mol)的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式:
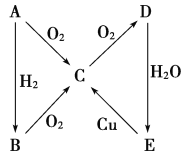
(1)当A为气体单质时,A是________,B是__________,C是________,D是________,E是________,E→C的化学方程式:_________________________________________________。
(2)当A为固体单质时,A是________,B是________,C是________,D是________,E是________,E→C的化学方程式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种氨化剂,易水解,难溶于CCl4。某小组设计下图所示装置制备氨基甲酸铵。已知:2NH3(g) + CO2(g)![]() H2NCOONH4(s) H<0。
H2NCOONH4(s) H<0。
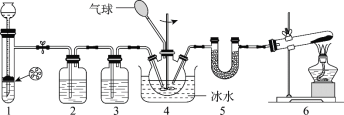
下列分析不正确的是
A.2中的试剂为饱和NaHCO3溶液
B.冰水浴能提高H2NCOONH4的产率
C.1和4中发生的反应均为非氧化还原反应
D.5中的仪器(含试剂)可用3中仪器(含试剂)代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
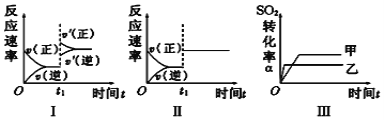
A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)珊瑚礁是珊瑚虫吸收海水中的钙和二氧化碳,然后分泌出石灰石,经过以后的压实、石化形成的礁石。珊瑚礁的主要成分是________(填化学式),近年来珊瑚礁受海水侵蚀,退化严重,请写出海水侵蚀珊瑚礁的化学方程式:_____________________。
(2)下图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。请回答:
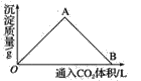
①OA段曲线所表示的化学反应方程式:_____________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com