
| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
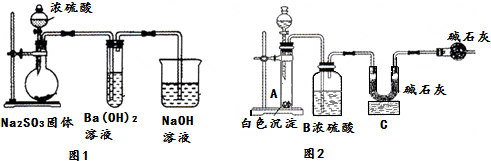
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | P1>P2,a+b=c+d | B. | Pl<P2,b=c+d | ||
| C. | T1>T2,正反应放热 | D. | Tl<T2,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com