
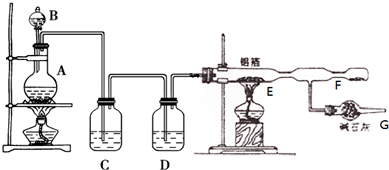
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、水和氯气;
(2)依据图中B的形状说出其名称;浓盐酸易挥发,制取的氯气中含有氯化氢,应除去氯化氢杂质;
(3)混合气体中含有氯化氢、水蒸气、氯气,AlCl3易升华且极易与空气中的水蒸气反应,氢气和氯气混合会发生爆炸;
(4)氯气有毒,应进行尾气处理,能被氢氧化钠吸收,碱石灰为干燥剂能够防止空气中的水蒸气进入E中;
(5)氯气与铝反应生成氯化铝;
(6)电解食盐水生成NaOH、氢气、氯气.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、水和氯气,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)图中B为分液漏斗,浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水除去氯气中等氯化氢;
故答案为:分液漏斗;饱和食盐水;
(3)因浓盐酸具有挥发性.反应生成物中有水,在加热条件下变成水蒸汽,所以混合气体中的成分是氯化氢、水蒸气、氯气;氯化氢和铝能反应生成氢气,氢气和氯气混合会发生爆炸.
故答案为:未经除去的氯化氢和水蒸气随氯气进入D中和铝能反应生成氢气,氢气和氯气混合会发生爆炸;
(4)氯气有毒,污染环境,所以不能排空;碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应达到,所以可用碱石灰处理尾气;空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂.
故答案为:吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入D中;
(5)氯气与铝反应生成氯化铝,方程式:2Al+3Cl2$\frac{\underline{\;加热\;}}{\;}$AlCl3,
故答案为:2Al+3Cl2$\frac{\underline{\;加热\;}}{\;}$AlCl3;
(6)电解食盐水生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题通过氯化铝的制取,考查了氯气的制备和性质的检验,熟悉反应原理是解题关键,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
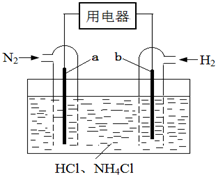 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
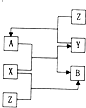 X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)
X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应起始时,两容器中生成N2O4的速率关系是v(A)=v(B) | |
| B. | 反应达到平衡前,两容器中生成N2O4的速率关系是v(A)<v(B) | |
| C. | 反应达到平衡后,NO2的转化率大小关系是v(A)<v(B) | |
| D. | 两容器均达到平衡后,再分别充入等量的氮气,发生平衡移动的是B容器,且平衡移动后,NO2的转化率将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com