
| A. | 用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液应用式碱滴定管盛装 | |
| C. | 滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色 | |
| D. | 经计算该样品中钙离子浓度为1.000×10-4g•mL-1 |
分析 A、高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应方程式为2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O;
B、高锰酸钾是强氧化剂,所以存放在酸式滴定管中;
C、高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
D、由CaC2O4+H2SO4═CaSO4+H2C2O4、2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出2 mL该血液中含钙的质量为:1.0×10-4mol/L×0.02L×2.5×40g/mol=2×10-4g,由此分析解答.
解答 解:A、高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应方程式为2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O,故A正确;
B、高锰酸钾是强氧化剂,所以存放在酸式滴定管中,而不是碱式滴定管,故B错误;
C、滴定终点时溶液由无色变为浅紫色,所以滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色,故C正确;
D、由CaC2O4+H2SO4═CaSO4+H2C2O4、2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出2 mL该血液中含钙的质量为1.0×10-4mol/L×0.02L×2.5×40g/mol=2×10-4g,1mL该血液中含钙:$\frac{2×1{0}^{-4}g}{2mL}$=1.0×10-4 g•mL-1,故D正确;
故选B.
点评 本题考查化学方程式书写、氧化还原反应、滴定应用、化学计算等,难度中等,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
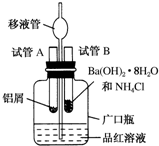 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互溶的液态混合物可用分液的方法分离 | |
| B. | 互不相溶的液态混合物可用分液的方法分离 | |
| C. | 沸点不同的液态混合物可用蒸馏的方法分离 | |
| D. | 氯化钠和氧化铜形成的混合物可以按溶解、过滤、蒸发的顺序分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
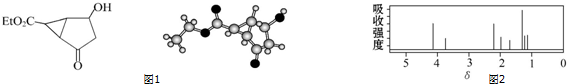
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,最后为零 | |
| C. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| D. | 随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com