
 (1)如图是维生素A的分子结构:
(1)如图是维生素A的分子结构:| m |
| M |
| m |
| M |
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、氦分子中含有共价键 |
| B、含有共价键的化合物一定是共价共价化合物 |
| C、离子化合物中可能含有极性共价键或非极性共价键 |
| D、同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||



查看答案和解析>>
科目:高中化学 来源: 题型:
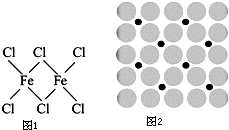 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 甲是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键),根据分子结构模型
甲是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键),根据分子结构模型查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学 |
| B、蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、米饭的主要成分是淀粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com