
【题目】下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( ) A.2 mol C
B.2 mol A、2mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol
A.3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)B中所含官能团名称是____________。
(2)E的分子式是________________。
(3)属于同一物质的是_____________(填序号)。
(4)上述分子中属于C的同系物的是__________(填序号)。
(5)等物质的量的上述烃,完全燃烧时消耗O2最多的是____,等质量的上述烃完全燃烧时消耗O2最多的是_________(填序号)。
(6)在120℃,1.01×105Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是______ (填序号)。
(7)分子式C8H18的烃,其一氯代物只有一种,该烃的名称为_____________________(用系统命名法命名)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在厨房里对水进行下列操作,能促进水的电离的是( )
A. 加入少量酒精 B. 加入少量食醋
C. 把水放入冰箱中使其降温至1℃ D. 把水加热至沸腾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4). 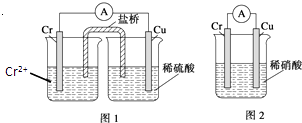
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为: . 盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl﹣进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式: .
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气.请解释这两种现象的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在观察DNA和RNA在细胞中的分布的实验里,下列哪项不是加入盐酸的作用( )
A. 改变细胞膜的通透性
B. 使染色体中DNA与蛋白质分离
C. 有利于DNA与染色剂结合
D. 有利于RNA分布在细胞质中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g)2ΝΗ3(γ)
起始浓度/molL﹣1 | 1.0 | 3.0 | 0.2 |
2s末浓度/molL﹣1 | 0.6 | 1.8 | 1.0 |
4s末浓度/molL﹣1 | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2s末氨气的反应速率=0.4mol(Ls)﹣1
B.前2s时间内氨气的平均反应速率=0.4mol(Ls)﹣1
C.前4s时间内氨气的平均反应速率=0.3mol(Ls)﹣1
D.2~4s时间内氨气的平均反应速率=0.2mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:

(1)A的结构式为________。
(2)D中含氧原子团的名称为_____,④的化学反应类型为_______。
(3)请分别写出⑤、⑥的化学方程式__________、_________。
(4)在实验室中,可用下图所示装置制取少量G,试管a中盛放的试剂是____,其作用为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①整个过程中FeO的作用是_________。
②写出CO2转化为炭黑的总反应方程式_________。
(2)已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

①下列说法正确的是_________。(填字母)
a.曲线a、b、c对应的温度是由低到高
b.加入催化剂能加快化学反应速率和提高H2的转化率
c.图中Q、M、N点的平衡常数:K(N) > K(Q) = K(M)
②M点对应H2的转化率是_________。
③2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 、
、![]() 和
和 ![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是_________和_________。
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是_________和_________。
(3)有机反应中也常用到催化剂。某反应原理可以用下图表示,写出此反应的化学方程式_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com