
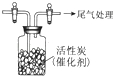
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.分析 【讨论】(1)该化合物中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0确定S元素化合价;
(2)用二氧化锰和浓盐酸加热反应制氯气,生成氯化锰、氯气和水,浓硫酸具有吸水性,可以干燥氯气;
Ⅰ.探究反应产物:
(3)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式;
Ⅱ.探究反应进行的程度.
(4)亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀;
【质疑】(5)SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫;根据反应物和生成物书写方程式.
解答 解:【讨论】(1)该化合物中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0知,S元素化合价=0-(-2)×2-(-1)×2=+6,
故答案为:+6;
(2)二氧化锰和浓盐酸反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,要收集干燥的氯气应除去氯气中的水蒸气,选用浓硫酸可以干燥氯气;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;
Ⅰ.探究反应产物:
(3)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式为SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
Ⅱ.探究反应进行的程度.
(4)亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀,用NaOH吸收的气体溶液中加入盐酸酸化的氯化钡溶液产生白色沉淀,说明剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应,
故答案为:由实验中产生的白色沉淀是BaSO4而不是BaSO3,说明用NaOH溶液吸收剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应;
【质疑】
(5)SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫,反应方程式为SOCl2+H2O=SO2+2HCl;
SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应如果生成SOCl2,Cl元素化合价降低、S元素化合价不变,不符合氧化还原反应特点,所以不会生成SOCl2,
故答案为:SOCl2+H2O=SO2+2HCl;SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应不会生成SOCl2.
点评 本题考查性质实验方案评价,为高频考点,涉及化合价的判断、离子检验、氧化还原反应等知识点,侧重考查学生知识运用能力、获取信息利用信息解答问题能力,熟悉基本理论、元素化合物性质是解本题关键,难点是证明SO2与Cl2是可逆反应的理由,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验开始时应先加热后通冷凝水 | |
| B. | 不能用湿润的pH试纸测定溶液的pH,否则必然会使实验结果产生误差 | |
| C. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)应过量 | |
| D. | 在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在量热剂中快速混合,并不断轻轻搅拌,测量混合液的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: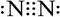 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃的相对分子量均为奇数 | |
| B. | 硝基化合物的相对分子量均是偶数 | |
| C. | 烃及烃的含氧衍生物的相对分子量均为偶数 | |
| D. | 酚、醛、氨基酸、酯的相对分子量均为奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
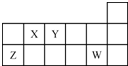
| A. | 原子半径的大小顺序:rZ>rY>rX | |
| B. | Y的简单氢化物水溶液呈酸性 | |
| C. | Y的氢化物与W的氢化物不能发生反应 | |
| D. | X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 | |
| B. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ②④①③ | C. | ④①②③ | D. | ②④③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com