
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其失电子能力越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.由于C、Si同属都IVA族,且C在Si的上一周期,则C的非金属性比Si强,则CH4比SiH4稳定,故A错误;
B.O2-与F-电子层结构相同,但氧的核电荷数少,所以O2-半径比F-的大,故B错误;
C.Na和Cs同主族,Cs金属性强,则Cs随着能力大于Na,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的非金属性:Cl>S>P,所以其最高价因为的水化物HClO4、H2SO4、H3PO4的酸性依次减弱,故D错误;
故选C.
点评 本题考查元素周期律,为高频考点,侧重考查学生知识综合运用能力,明确金属性、非金属性强弱判断方法及其对应的元素周期律是解本题关键,知道离子半径比较方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
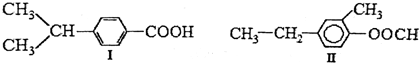
| A. | 两种物质的分子式均为C10H14O2互为同分异构体 | |
| B. | 两种物质均能发生加成和取代反应 | |
| C. | 两种物质都有甲基、苯环和羧基 | |
| D. | 两物质都含有双键因此都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
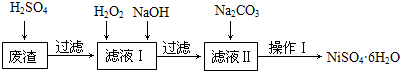
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.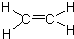 ,C的名称为乙醛.
,C的名称为乙醛.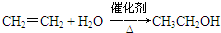 ④
④ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com