
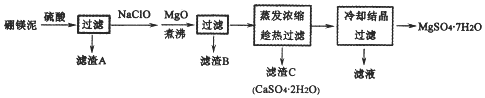
分析 硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,
(1)化学式中元素化合价代数和为0计算;
(2)渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体为MnO2,加入的NaClO可与Mn2+反应生成MnO2,结合电子守恒和原子守恒配平书写离子方程式,元素化合价升高的做还原剂,元素化合价降低的做氧化剂,氧化剂被还原得到还原产物;
(3)加入MgO的目的是调节溶液PH沉淀铁离子,加入的试剂和酸反应但不能引入新的杂质;
(4)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O;
(5)每克含氢还原剂的还原能力相当于多少克H2的还原能力,则NaBH4变化为H+,电子转移和氢气变化为氢离子电子转移相同,据此计算;
解答 解:硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,
(1)Na2B4O7•10H2O中,钠的化合价+1价,氧元素化合价-2价,元素化合价代数和为0计算得到B的化合价为:2×(+1)+4x+(-2)×7=0,x=+3,
故答案为:+3;
(2)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,生成黑色固体的离子方程式为:ClO-+Mn2++H2O=MnO2+Cl-+2H+,该反应中氯元素化合价+1价变化为-1价,次氯酸钠做氧化剂,锰离子做还原剂,氧化剂与还原剂的物质的量之比为1:1,还原产物为Cl-,
故答案为:ClO-+Mn2++H2O=MnO2+Cl-+2H+;1:1;Cl-;
(3)加入MgO的目的是调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去,该过程除了加入MgO外,还能选择加入物质能和酸反应调节溶液PH,且不能引入新的杂质,选择①碳酸镁,③氢氧化镁,②氨水会引入铵根离子,④氢氧化钠加入会引入钠离子,故选①③,
故答案为:调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去;①③;
(4)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O,其反应方程式为:4H3BO3+2NaOH+3H2O=Na2B4O7•lOH2O,
故答案为:4H3BO3+2NaOH+3H2O=Na2B4O7•10H2O;
(5)每克含氢还原剂的还原能力相当于多少克H2的还原能力,则NaBH4变化为H+,电子转移8e-,电子转移和氢气变化为氢离子电子转移相同,设相当于氢气质量为x,计算为:
$\frac{1\\;g}{37.8g/mol}$×8=$\frac{\\;x}{2}$×2
x=0.21g
故答案为:0.21;
点评 本题考查物质制备工艺流程,涉及物质的分离与提纯、对原理与条件控制分析、盐类水解等,关键是对工艺流程理解,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
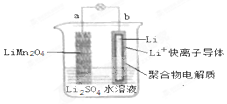 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0mol•L-1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
| 操作 | 现象 |
| 将5mL 1.0mol•L-1的FeCl3溶液与0.65g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将5 mL 0.2 mol•L-1(或pH=0.7)的盐酸与0.65g锌粉混合 | 溶液中立即产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦ | B. | ①②⑤⑦ | C. | ②④⑥ | D. | ②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
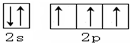 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀X的成分是SiO2 | |
| B. | 将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 | |
| C. | 在溶液Y中加入过量的NaOH溶液,过滤得到沉淀是Fe(OH)3 | |
| D. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 有机物 | 试剂 | 现象 |
| (1)甲苯 | a.碘水 | A.出现光亮的银镜 |
| (2)乙醛 | b.高锰酸钾酸性溶液 | B.呈紫色 |
| (3)苯酚 | c.浓硝酸 | C.呈蓝色 |
| (4)淀粉 | d.新制银氨溶液 | D.呈黄色 |
| (5)蛋白质 | e.三氯化铁溶液 | E.紫色褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com