
| A.增大、减小、减小 | B.增大、减小、增大 |
| C.减小、增大、增大 | D.减小、增大、减小 |
科目:高中化学 来源:不详 题型:填空题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
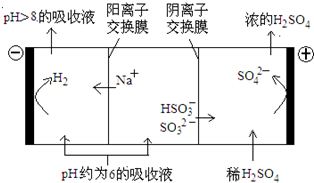
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HS-+H20?H3O++S2- | ||||
B.
| ||||
C.
| ||||
D.
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| B.相同温度下,等物质的量浓度的Na2CO3和NaHCO3溶液pH:Na2CO3>NaHCO3 |
| C.将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近有大量白烟产生 |
| D.HCl、NH3、CO2都极易溶于水,都可用水作吸收剂做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾能起催化剂作用 |
| B.明矾更易使碳酸氢钠发生分解反应 |
| C.明矾受热分解放出气体 |
| D.明矾在水中能起到酸的作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com