
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
分析 A.满足物料守恒:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+);
B.水解分步进行,以第一步水解为主;
C.,发生氧化还原反应,电子、电荷不守恒;
D.AgI的Ksp更小,发生沉淀的转化.
解答 解:A.由物料守恒可知,c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L,溶液中还含钠离子、氢离子、氢氧根离子,故A错误;
B.硫化钠水解的离子方程式为S2-+H2O?HS-+OH-,故B错误;
C.FeSO4溶液中滴加次氯酸钠溶液的离子反应为2Fe2++ClO-+5H2O=2Fe(OH)3↓+4H++Cl-,故C错误;
D.发生沉淀的转化,可知先产生白色沉淀后转化为黄色沉淀,故D正确;
故选D.
点评 本题考查较综合,涉及氧化还原反应、盐类水解、沉淀转化等,为高频考点,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,注意物料守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 →
→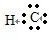
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池,阳极Pt,阴极用Cu,纯水做电解液 | |
| B. | 原电池,负极用Cu,正极用石墨,氯化钠溶液做电解液 | |
| C. | 电解池,阳极用Cu,阴极用石墨,H2SO4做电解液 | |
| D. | 电解池,阳极用Cu,阴极用石墨,Na2SO4做电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
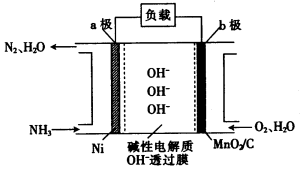
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

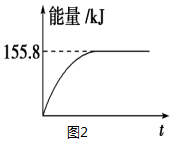
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
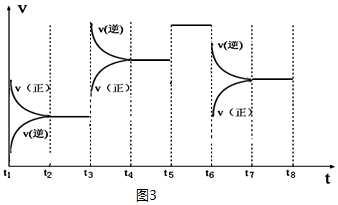
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| B. | 1 mol H2与1 mol I2 (g)混合后充分反应生成的HI分子数为2NA | |
| C. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| D. | 25℃时,100 mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com