
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它的存在。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A.是一种新的氧化物B.不可能含有极性键
C.是极性分子D.是臭氧的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体和离子晶体是重要的晶体类型。下列关于它们的说法正确的是( )
A.金属晶体和离子晶体都能导电
B.在镁晶体中,1个Mg2+只与2个自由电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取密堆积方式
D.金属晶体和离子晶体中分别存在金属键和离子键等,化学键很难断裂,因而都具有延展性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是
A. Br2+2KI═I2+2KBr B. NH3+HCl═NH4Cl
C. NO+NO2+2NaOH═2NaNO2+H2O D. 2H2O2═2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于加成反应的是
A.己烯使酸性高锰酸钾溶液褪色 B.将苯滴入溴水中,振荡后水层接近五色
C.乙烯使溴水褪色 D.甲烷与氯气混合光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A.CH3COOH + Na2CO3 ==NaHCO3 + CH3COONa
B.CH3COOH + NaCN ==CH3COONa+ HCN
C.CO2 + H2O+ 2 NaClO ==Na2CO3+2 HClO
D.NaHCO3 + HCN == NaCN+ H2O+ CO2↑
(3)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb= ____________。(用含a的代数式表示)
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,由图可知滴定时指示剂应选用__________ (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是_________点对应的溶液;
③比较A、C两点中水的电离程度:A ______ C(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
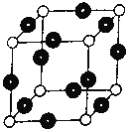
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
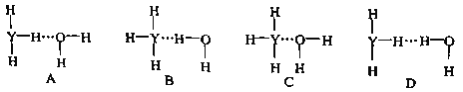
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 ![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氨原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氨原子数之比为( )
A.5:3
B.5:4
C.1:1
D.3:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com