
分析 (1)将0.2mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,恰好反应生成NaA,测得混合溶液中c(Na+)>c(A-),说明HA是弱酸弱酸阴离子水解生成的HA;
(2)依据溶液中物料守恒计算得到;
(3)溶液中NaA水解显碱性;
(4)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA和HA,且二者的物质的量浓度相等,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度.
解答 解:(1)将0.2mol/L HA 溶液与 0.2mol/L NaOH溶液等体积混合,则溶液中的溶质是NaA,物质的量浓度是0.1mol/L,混合溶液中c(Na+)>c(A-),说明A-离子水解显碱性,A-+H2O?HA+OH-,c(HA)<c(A-);
故答案为:<;
(2)溶液中c(H+)<c(OH-),溶液NaA呈碱性,根据物料守恒得c(HA)+c(A-)=0.1mol/L,
故答案为:=;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中,由水电离出来的c(OH-)>0.2mol/L HA溶液中由水电离出的c(H+),故答案为:>;
(4)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度;
故答案为:>.
点评 本题考查了酸碱混合溶液定性判断,根据混合溶液中溶质及溶液的酸碱性确定弱电解质的电离程度和弱根离子的水解程度相对大小,难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径C3->D->B+>A2+ | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q | B. | Q1<Q | C. | 2Q1<Q | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
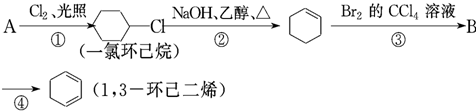
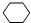
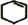 +Br2→
+Br2→ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物中一定存在化学键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| D. | 离子化合物中可能含共价键,共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 | 甲、乙两种分子一定是同分异构体 |
| C | 致冷剂氟里昂(二氯二氟甲烷)不存在同分异构体 | 甲烷分子为正四面体构型 |
| D | 将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 | 使KMnO4褪色的一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com