
【题目】为测定某补血剂样品【主要成分是硫酸亚铁晶体(FeSO4·7H2O)】中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用标准酸性KMnO4溶液滴定以测定铁元素的含量
⑴ 写出滴定反应的离子方程式 。
⑵ 下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。

⑶ 实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称)
方案二:将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

⑷ 步骤②中除用H2O2外还可以使用的物质是 。
⑸ 步骤②是否可以省略 ,理由是 。
⑹ 步骤④中一系列操作依次是:过滤、 、 、冷却、称量。
⑺ 假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
【答案】⑴ 5Fe2+ + MnO4-+8H+=5Fe3+ + Mn2+ + 4H2O;(2分)⑵ B;(1分)⑶ 250mL容量瓶;(1分)
⑷ 氯水;(1分)⑸ 否(1分),Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;(2分) ⑹ 洗涤(1分) 灼烧(1分) ⑺ 0.07a(2分)
【解析】
试题分析:方案一:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O;
(2)酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故B最合适;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
方案二:
(3)步骤②加入有强氧化性试剂,能将Fe2+全部氧化为Fe3+,除用H2O2外还可以使用氯水等;
(5)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(7)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量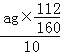 =0.07ag。
=0.07ag。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
(i)H2(g)+ I2(g)![]() 2HI(g);△H= -9.48kJ/mol
2HI(g);△H= -9.48kJ/mol
(ii)H2(g)+ I2(s)![]() 2HI(g);△H= +26.48kJ
2HI(g);△H= +26.48kJ
A.1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol I2(s)升华,吸热17.00 kJ
![]() C.反应(i)的产物比反应(ii)的产物稳定
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: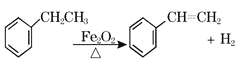 ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
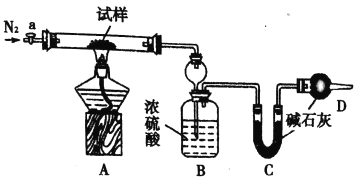
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:________________;_______________。
(2)装置B的作用为_______________。装置C的作用为_______________。
(3)实验过程中通入N2的目的为__________。
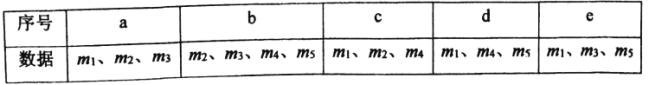
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是_______(填选项字母)
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:____________(若不能,此问不作答。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 | ||
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g的镁、铜合金加到一定量的稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后溶液中加入5mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金质量增加10.2g,则下列叙述正确的是( )
A.当金属全部溶解时,无法计算出参与反应的硝酸的物质的量
B.7.2<m<19.2
C.当金属全部溶解时,收集到NO气体的体积一定为4.48L
D.当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写2种)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、低温烘干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com