
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 乙醇的结构式为: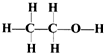 | |
| C. | 用电子式表示Na2S的形成过程可表示为: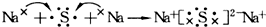 | |
| D. | 丙烷的比例模型为: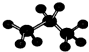 |
分析 A.乙烯分子中含有碳碳双键,结构简式中需要标出官能团结构;
B.将分子中所有共用电子对用短线表示即为结构式;
C.硫化钠为离子化合物,其电子式中需要标出阴阳离子所带电荷;
D. 为丙烷的球棍模型,表示比例模型.
为丙烷的球棍模型,表示比例模型.
解答 解:A.乙烯分子中含有官能团碳碳双键,乙烯的结构简式为:CH2=CH2,故A正确;
B.乙醇分子中含有官能团羟基,乙醇的结构式为: ,故B正确;
,故B正确;
C.硫化钠为离子化合物,其电子式中需要标出阴阳离子所带电荷,用电子式表示Na2S的形成过程可表示为: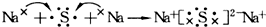 ,故C正确;
,故C正确;
D.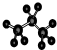 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故D错误;
,故D错误;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型与球棍模型、电子式、结构式、结构简式等知识,明确常见化学用语的书写原则为解答关键.


科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: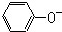 +CO2+H2O→ +CO2+H2O→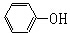 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1 mol Na2S2O3,转移4 mol电子 | |
| D. | 相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
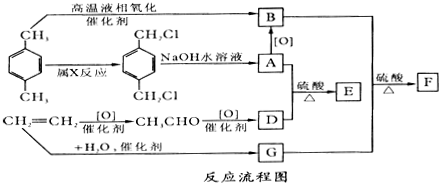
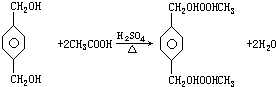 ;B+G→F
;B+G→F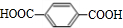 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$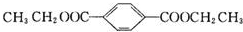 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 所对应的化学反应 |
| A | HCO3-+OH-+Ca2+═CaCO3↓+H2O | 既可以表示少量NaHCO3与过量石灰水反应,也可以表示少量NaOH与过量Ca(HCO3)2反应 |
| B | H++OH-═H2O | 代表任何强酸与强碱反应 |
| C | Fe+2H+═Fe2++H2↑ | 代表铁与所有强酸反应 |
| D | Al3++4NH3•H2O═4NH4++AlO2-+2H2O | 代表可溶性铝盐与过量氨水反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4和C4H6 | B. | C2H5Cl和C3H6Cl2 | ||
| C. | CH2=CH2和CH2=CH-CH=CH2 | D. | C3H8和C5H12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com