
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
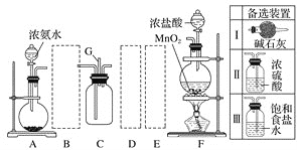
请回答下列问题:
(1)装置A中的烧瓶内固体可选用__(填字母)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:B__,D__,E__。
(3)通入C装置的两根导管左边较长、右边较短,目的是__。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__;其中氧化剂与还原剂的物质的量之比为__;当amol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为__mol-1(用含a、b的代数式表示)。
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?_。
【答案】ABE Ⅰ Ⅱ Ⅲ 使密度较大的Cl2和密度较小的NH3较快地混合均匀 3Cl2+8NH3=N2+6NH4Cl 3:2 ![]() 在G后连接导管,直接把尾气通入盛有NaOH溶液的烧杯中
在G后连接导管,直接把尾气通入盛有NaOH溶液的烧杯中
【解析】
探究氯气和氨气的反应,则首先要制得氨气和氯气,装置A用于制取氨气,制得的氨气中含有水蒸气,需要除去,干燥氨气选用碱石灰,装置F制取氯气,氯气中含有HCl和H2O,需要除去和干燥,利用饱和食盐水除去HCl,利用浓硫酸除去H2O。在C中发生氨气与氯气的反应。
(1)装置A用于制取氨气,碱石灰、生石灰、烧碱遇水都会放热,使氨水温度升高,导致氨气逸出,可以选ABE;
(2)氨气是碱性气体,要用碱性干燥剂碱石灰干燥;由于浓盐酸有挥发性,所以制取的Cl2含有杂质HCl,应该先用饱和NaCl溶液除去其中的HCl,再用浓硫酸干燥,所以B选Ⅰ装置,D选Ⅱ装置,E选Ⅲ装置,经过除杂干燥后在装置C中发生反应;
(3)氨气的密度比Cl2的密度小,通入C装置的两根导管左边较长、右边较短,就可以使密度较大的Cl2和密度较小的NH3较快地混合均匀;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。则白色固体是NH4Cl,另一生成物是N2,根据得失电子守恒、原子守恒可得该反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl;在该反应中氧化剂是Cl2,还原剂是NH3,每有3molCl2发生反应,消耗8molNH3,其中有2molNH3做还原剂。故氧化剂与还原剂的物质的量之比为3:2;当amol氯气参加反应时,转移的电子为2amol,转移电子的个数为b,所以阿伏加德罗常数为NA=![]() mol-1;
mol-1;
(5)从装置C的出气管口G处逸出的尾气可能含有Cl2、NH3,Cl2能够与NaOH溶液发生反应,NH3易溶于NaOH溶液,则应该将尾气通入到盛有NaOH溶液的烧杯中。


科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将 H2O 和CO2 转化为 O2 和燃料(C3H8O)。下列说法正确的是( )
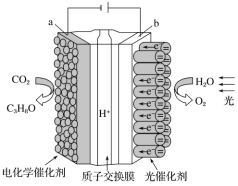
A.该装置将化学能转化为光能和电能
B.每生成 1 mol O2,有 44 g CO2 被还原
C.该装置工作时,H+从 b 极区向 a 极区迁移
D.a 电极的反应为 3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
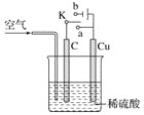
(1)甲同学认为,不通入空气,将 K 与_____(填“a”或“b”)连接,即可实现。则总反应的离子方程式为_____。
(2)乙同学认为在通入空气的同时,将开关 K 与_____连通,也可以实现,则电池总反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在2L密闭容器中加人一定量A,发生以下化学反应:2A(g)![]() B(g)+C(g) ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是
B(g)+C(g) ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是

A.反应达平衡时,A的转化率为80%
B.A的初始物质的量为4mol
C.反应到达平衡时,放出的热量是193kJ
D.15min时,v正= v逆=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是哥本哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是__________(填字母编号)。
A 采用节能技术,减少化石燃料的用量
B 鼓励乘坐公交车出行,倡导“低碳”生活
C 利用太阳能、风能等新型能源替代化石燃料
(2)CH4是另一种主要的温室气体,lg甲烷完全燃烧生成液态水和二氧化碳,放出55.64kJ的热量,写出表示甲烷燃烧的热化学方程式_______________。
(3)酸雨的形成主要是由废气中的SOx和NOx造成的,某空气污染监测仪是根据SO2与Br2、H2O的定量反应来测定空气中SO2含量的,该反应的化学方程式为:____________。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2:第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2:第二阶段的反应原理是2SO2(g)+O2(g)![]() 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是__________(填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是__________(填字母编号)
A SO2为5mol·L-1,O2为3.5mol·L-1
B SO2为3mol·L-1
C SO2、SO3均为2.5mol·L-1
D SO3为5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(gcm-3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_____。
(2)实验中,应选择_____(填序号)作为冷凝回流装置,该仪器的名称为_____。
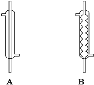
(3)使用过量甲醇的原因是_____。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是_____,操作b的名称为_____。
(5)该实验中制得苯甲酸甲酯8.5g,则苯甲酸甲酯的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
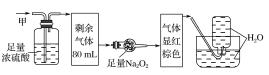
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
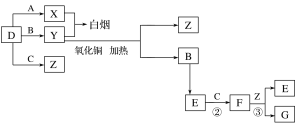
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
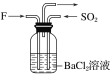
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。(查阅资料:饱和NaClO溶液pH为11)。回答下列问题:
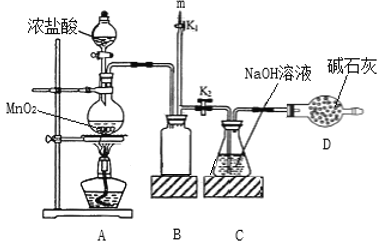
(1)装置A中发生反应的离子方程式为_______。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:______________________________。
②滴定终点的现象为__________________________________________________。
③C瓶溶液中NaClO含量为____________g·L-1。
④若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是( )
SnI4制备SnI4。下列说法错误的是( )
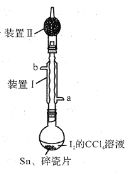
A. 加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C. 装置Ⅰ中a为冷凝水进水口
D. 装置Ⅱ的主要作用是吸收挥发的I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com