
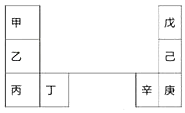
 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
分析 戊的一种单质是自然界硬度最大的物质,可知戊为C,甲和戊的原子序数相差3,则甲为Li,结合元素在周期表的位置可知,乙为Na,丙为K,丁为Ca,己为Si,庚为Ge,辛为Ga,以此来解答.
解答 解:A.同主族从上到下金属性增强,同主族从左向右金属性减弱,结合金属活泼性顺序为金属性:甲<乙<丁,故A错误;
B.电子层越多,原子半径越大,则原子半径:辛>己>戊,故B正确;
C.丙和庚的原子核外电子数相差32-19=13,故C错误;
D.乙的单质在空气中燃烧生成过氧化钠,含离子键、共价键,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物性质、元素在周期表的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识与规律性知识的应用,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:实验题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
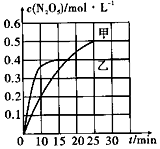 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
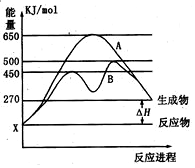 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com