
【题目】按下列要求作答。
(1)第二周期中,第一电离能介于B和N之间的元素共有_________种。
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有_________种。
(3)硅烷(Si,H2H2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___________________________。
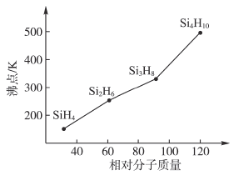
【答案】3 4 硅烷是分子晶体,结构相似,相对分子质量越大,范德华力越大,沸点越高。
【解析】
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有Ti、Ni、Ge、Se,核外电子排布分别为[Ar]3d24s2、[Ar]3d84s2、[Ar]3d104s24p2、[Ar]3d104s24p4;
(3)结构相似的分子晶体,相对分子质量越大,范德华力越大,沸点越高(含有氢键的物质例外)。
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以第二周期中第一电离能顺序为:Li<B<Be<C<O<N,第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)由分析可知,第四周期中,原子核外电子排布有两个未成对电子的元素有Ti、Ni、Ge、Se四种元素;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,范德华力越大,沸点越高。


科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
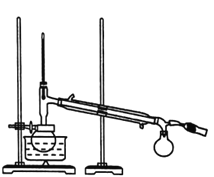
【题目】实验室制备无水乙醇常用蒸馏法,实验步骤如下。
Ⅰ.回流。如图所示,在100mL圆底烧瓶中加入10g小颗粒状的生石灰和少量氢氧化钠,慢慢注入50mL工业乙醇,回流1h。
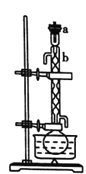
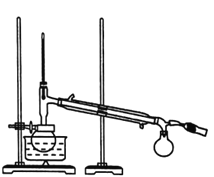
Ⅱ.蒸馏。如图所示,回流完毕,待烧瓶冷却后在烧瓶中加入几粒沸石,改为蒸馏装置,收集78℃时的馏分,即为无水乙醇。(用△表示酒精灯)。
试回答下列问题:
(1)装置b的名称是________。
(2)简述向烧瓶中加入生石灰的方法____________。
(3)加入![]() 固体是为了除去工业乙醇中少量的醛,发生的反应为
固体是为了除去工业乙醇中少量的醛,发生的反应为![]() ,该反应的反应类型为_______,回流1h的目的是________。
,该反应的反应类型为_______,回流1h的目的是________。
(4)蒸馏时,待温度计示数为78℃左右时,尾接管中出现液滴,弃去开始流出的液体,原因是_______。
(5)有同学建议改蒸馏为过滤,请回答过滤法不妥的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备无水乙醇常用蒸馏法,实验步骤如下。
Ⅰ.回流。如图所示,在100mL圆底烧瓶中加入10g小颗粒状的生石灰和少量氢氧化钠,慢慢注入50mL工业乙醇,回流1h。
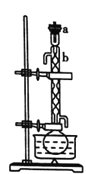
Ⅱ.蒸馏。如图所示,回流完毕,待烧瓶冷却后在烧瓶中加入几粒沸石,改为蒸馏装置,收集78℃时的馏分,即为无水乙醇。(用△表示酒精灯)。
试回答下列问题:
(1)装置b的名称是________。
(2)简述向烧瓶中加入生石灰的方法____________。
(3)加入![]() 固体是为了除去工业乙醇中少量的醛,发生的反应为
固体是为了除去工业乙醇中少量的醛,发生的反应为![]() ,该反应的反应类型为_______,回流1h的目的是________。
,该反应的反应类型为_______,回流1h的目的是________。
(4)蒸馏时,待温度计示数为78℃左右时,尾接管中出现液滴,弃去开始流出的液体,原因是_______。
(5)有同学建议改蒸馏为过滤,请回答过滤法不妥的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议新修订了阿伏加德罗常数的值(NA=6.02214076×1023 mol-1),并于2019年5月20日正式生效,下列叙述正确的是
A.32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B.含16 g氧原子的二氧化硅晶体中含有的σ键数目为NA
C.1.2 g金刚石与石墨的混合物中含有碳碳单键的数目为0.4NA
D.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月22日,位于资阳市境内的“安岳气田”天然气产量达到10.33亿立方米,历史性突破10亿立方米大关。“安岳气田”的开发,将惠及川渝地区天然气供给,促进地方经济社会的发展。对天然气的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用。
(1)已知甲烷临氧耦合CO2重整反应有:
反应I:2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
反应II:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
已知断裂1 mol化学键所需的能量:
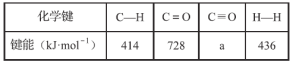
①a=_________。
②写出表示CO燃烧热的热化学方程式:____________________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下进行(1)中反应II(不发生其它反应),CO2的平衡转化率如下表所示:
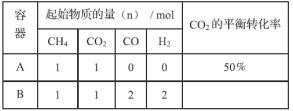
①若容器A中反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(CO2)=_________(用含t的表达式表示)。
②温度为753K时该反应的平衡常数K=_________;容器B中的反应起始时将_________移动(填“正向”、“逆向”或“不”)。
③该反应达到平衡时,其他条件不变,若升高温度,此时v正_________ v逆(填“>”、“=”或“<”)。
④当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系:2n(CO)A______n(CO)B(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ(CO)]与温度(T)的关系如图如示。
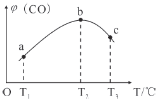
bc段CO的体积分数[φ(CO)]降低的主要原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
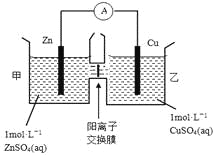
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/L NaOH溶液滴定分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00 mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:
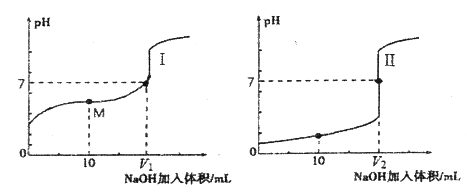
(1)滴定醋酸的曲线是_____________(填“Ⅰ”或“Ⅱ”)。
(2)下列方法中可使溶液中醋酸的电离程度减小的是_____________(填字母序号)。
A. 微热溶液 B. 加少量冰醋酸
C. 加少量醋酸钠固体 D. 加少量碳酸钠固体
(3)V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com