
实验室欲配制90mL浓度为1.00mol·L-1的Na2CO3溶液:
(1)配制时的实验步骤为:计算、称量、溶解、转移(洗涤)、 、摇匀;
(2)本实验中必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、量筒、胶头滴管、
(注明所需仪器的规格)。
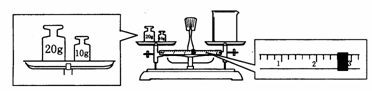
(3)某同学欲称量Na2CO3的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为 g,要完成本实验该同学应称出 g Na2CO3。
(4)使用容量瓶前必须进行的一步操作是 。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①没有洗涤烧杯和玻璃棒 ;②容量瓶不干燥,含有少量蒸馏水 ;
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,
C(s)+4D(g) ΔH<0,
右图中a、b表示一定条件下,D的体积分数随时间t的变化
情况。若要使曲线b变为曲线a,可采取的措施是( )
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
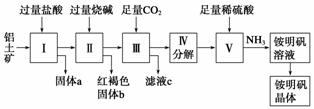
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
 (3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中产生的现象与右边座标图形相符合的是
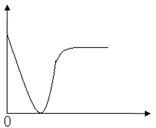 A.稀盐酸滴加到一定量NaOH溶液中
A.稀盐酸滴加到一定量NaOH溶液中
(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B.铁粉加到一定量CuSO4溶液中
(横坐标是铁粉的质量,纵坐标为沉淀质量)
C.CO2通入一定量NaOH溶液中
(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中
(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,在一定条件下发生A+3B 2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
A.0.04mol/(L.s) B.0.08mol/(L.s) C.0.4mol/(L.s) D.0.8mol/(L.s)
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下, 转化为
转化为 的反应为
的反应为 该反应的平衡常数表达式为K= ;过量的
该反应的平衡常数表达式为K= ;过量的 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com