
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
(i)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体g.
(ii)从图中选择称量NaOH固体所需要的仪器是(填字母):
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示. 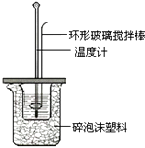
(i)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(ii)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4/p> | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
【答案】
(1)5.0;a b e
(2)H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+H2O(l)△H=﹣114.6kJ/mol;4.0;﹣53.5 kJ/mol;acd
【解析】解:(1)(i)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,所以答案是:5.0;(ii)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,所以答案是:a b e;(2)(i)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,所以答案是:
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,所以答案是: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;(ii)①温度差平均值=
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;(ii)①温度差平均值= ![]() ,但是第2组数据明显有误,所以删掉,
,但是第2组数据明显有误,所以删掉,
温度差平均值 ![]() =4.0°C,所以答案是:4.0;②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=﹣
=4.0°C,所以答案是:4.0;②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=﹣ ![]() =﹣53.5 kJ/mol,
=﹣53.5 kJ/mol,
所以答案是:﹣53.5kJ/mol;③a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,故d正确.
所以答案是:acd.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】下列关于乙醇和乙酸的说法错误的是
A.乙醇和乙酸都是常用调味品的主要成分
B.相同条件下与金属钠反应的速率,乙醇比乙酸慢
C.医用酒精属于混合物,醋酸是一元弱酸
D.乙酸乙酯在碱性条件下的水解反应称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( ) 
A.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.反应CH4+H2O ![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体是盐酸,向烧杯内滴加少量盐酸时,发现U形管内液体右移,静止冷却后液面左边低于右边,则烧杯内的物质不可能是
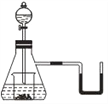
A. 过氧化钠 B. 碳酸氢钠
C. 氧化钠 D. 铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com