
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
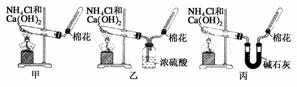
(1)三位同学制取氨气的化学方程式为:
________________________________________________________________________。
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是________。
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大 D.氨气密度比空气小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是________。
A.闻到有氨气逸出
B.棉花被气体冲出
C.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是________(填“甲”、“乙”或“丙”)。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下:
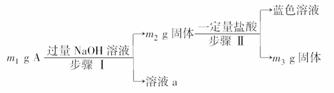
下列分析不正确的是( )
A.当m1>m2时,溶液a中阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含Al,可取A加入适量稀HCl
D.当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
以苯酚为原料合成  的路线如下所示.请按要求作答:
的路线如下所示.请按要求作答:

(1)写出以下物质的结构简式:B ,F .
(2)写出反应④、⑤的化学反应方程式:④ ⑤
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为, .
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A,其结构如下:
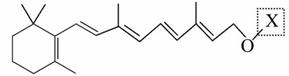
在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用。为
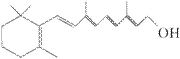 了研究X的结构,将化合物A在一定条件下水解只得到B( )
了研究X的结构,将化合物A在一定条件下水解只得到B( )
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应____________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式____________。
(3)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含有五元环);
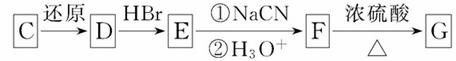
已知:RCOOH RCH2OH,RX
RCH2OH,RX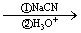 RCOOH
RCOOH
①确认化合物C的结构简式为_______________________________________。
②F G反应的化学方程式为______________________________________。
G反应的化学方程式为______________________________________。
③化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体的结构简式:_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,在三个干燥的烧瓶内分别装有干燥、纯净的NH3;含一半空气的氯化氢气体;NO2和O2体积比为417的混合气体。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
A.2:1:2 B.5:5:4
C.1:1:1 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
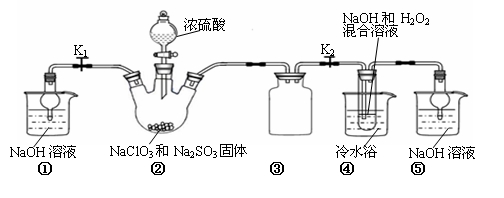
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤代烃广泛用于化工生产,下列关于卤代烃的说法正确的是( )
A.卤代烃性质稳定,不会对环境造成破坏
B.卤代烃均难溶于水
C.卤代烃都能发生消去反应
D.有小分子(如水)生成的反应是消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
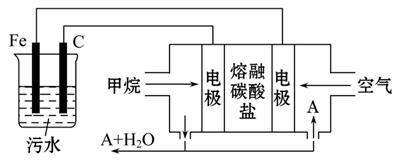
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
Ⅰ.________________________________________________________________;
Ⅱ.________________________________________________________________。
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是________
__________________________________________________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是___
___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com