
【题目】下列热化学方程式书写正确的是( )
A.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g ) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
C.2NO2=O2+2NO ΔH=+116.2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-296.8 kJ·mol-1
【答案】D
【解析】
A、相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,选项A错误;
B、酸碱中和反应是放热反应,正确的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,选项B错误;
C、选项中的方程式未标注物质聚集状态,不符合热化学方程式书写原则,选项C错误;
D、S(s)+O2(g)=SO2(g)△H=-269.8kJmol-1(反应热)符合热化学方程式书写原则,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】在一定温度,将各为1mol的CO和水蒸气放在体积不变密闭容器反应:CO(g) +H2O(g)![]() H2(g) + CO2(g)达到平衡后测得CO2为0.6mol,再通入4mol的水蒸气达到新的平衡,下列说法错误的是()
H2(g) + CO2(g)达到平衡后测得CO2为0.6mol,再通入4mol的水蒸气达到新的平衡,下列说法错误的是()
A.CO2的物质的量不可能为1molB.水蒸气的转化率提高
C.CO2的浓度比水蒸气的浓度小D.密闭容器的压强是原先的3倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
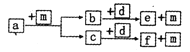
A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。
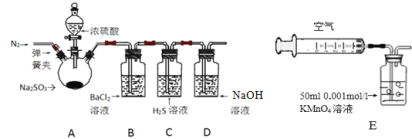
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100 ℃、1.01×105 Pa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法不正确的是( )
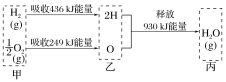
A.1 mol H2O(g)分解为2 mol H与1 mol O时吸收930 kJ热量
B.热化学方程式为:2H2(g)+O2(g)=2H2O(g) ΔH=-490 kJ·mol-1
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1000mol·L-1的盐酸逐滴加入到20.00mL 0.1000mol·L-1的氨水中,溶液的pH和pOH[注:pOH=-lgc(OH-)]与所加盐酸体积的关系如图所示,下列说法中不正确的是( )
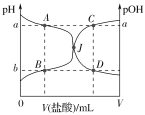
A.图中a+b=14
B.交点J点对应的V(HCl)=20.00 mL
C.点A、B、C、D四点的溶液中均存在如下关系:c(Cl-)-c(NH4+)=c(H+)-c(OH-)
D.若在绝热体系中发生上述反应,图中的交点J向右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于可逆反应的是( )
①N2+3H2![]() 2NH3,2NH3
2NH3,2NH3![]() 3H2+N2
3H2+N2
②2NaHCO3![]() Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH![]() CH2===CH2↑+H2O,CH2===CH2+H—OH
CH2===CH2↑+H2O,CH2===CH2+H—OH![]() CH3CH2OH
CH3CH2OH
④2Na+Cl2![]() 2NaCl, 2NaCl
2NaCl, 2NaCl![]() 2Na+Cl2
2Na+Cl2
A.只有①B.①②③
C.①②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
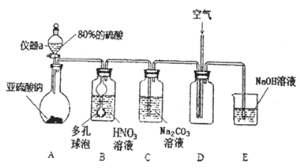
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]() span>
span>![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com