
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下:

下列有关说法不正确的是
A. 制取粗硅时生成的气体产物固态时可用于人工降雨
B. 生产铝、铜、高纯硅过程中均涉及氧化还原反应
C. 黄铜矿冶炼铜时产生的副产物,可用于生产硫酸和冶铁
D. 玻璃与水泥-样,主要成分都是硅酸盐
科目:高中化学 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
____Mn2++____H5IO6===_____MnO4-+____IO3-+_____H++_____
(2)根据以上离子方程式判断H5IO6是_____酸(填“强”或“弱”)。
(3)上述反应,被氧化的元素是_____(填元素符号),该反应的转移电子数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用下图所示装置研究苯与液溴的反应类型并制取少量溴苯。试回答下列各小题。

(1)写出下列仪器的名称:A___________;仪器B除导气外的作用是_______。
(2)写出制取溴苯的化学反应方程式_______________________
(3)反应完毕后,向锥形瓶D中滴加AgNO3溶液有______(填现象)生成,此现象说明这种获得溴苯的反应属于_________(填有机反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Cl2通入浓氨水中,发生如下反应:3Cl2 +8NH3=6NH4Cl +N2
(1)用双线桥表示反应的电子转移方向和数目:____。
(2)发生化学反应的Cl2与NH3的分子数之比为:__,反应中发生电子转移的Cl2与NH3的分子数之比为:___。
(3)写出NH4Cl在溶液中的电离方程式___,在其溶液中分散质粒子的直径范围为___。
(4)若反应中有6.8克氨发生氧化反应,则反应中有生成氮气的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是

A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “![]() ” 基团是酯基
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有Fe3+、Cu2+、SO42-等离子,为了减少污染并变废为宝,工厂计划从该废水中回收金属铜并得到硫酸亚铁(Fe+2FeCl3=3FeCl2)。生产流程如下图所示(所加试剂均为过量)请回答:

(1)试剂①应该是___________,A 中含有的物质是_________(填物质的名称)。
(2)步骤①采取的操作为__________,步骤③中还需分离提纯方法是蒸发浓缩、______。
(3)写出步骤②中发生的离子方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
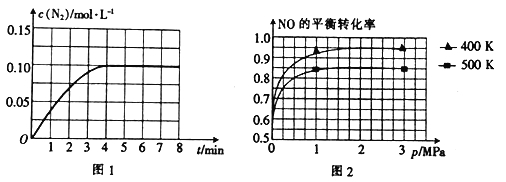
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ molL-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com