
60 g石灰石在高温下与23 g石英反应产生的气体在标准状况下的体积是
A.5.6 L B.11.2 L
C.13.44 L D.6.72 L
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O H2CO3
H2CO3
C.CO32-+H2O  HCO3-+OH-
HCO3-+OH-
D.HCO3-+H2O CO32- +H3O+
CO32- +H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2 : 1 : 2
2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2 : 1 : 2
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. FeCl3 、KAl(SO4)2、Na2CO3的水溶液均显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A.浓硫酸的体积增大 B.澄清石灰水变浑浊
C.氢氧化钠的表面发生潮解 D.铝锅表面生成致密的薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组只领取下列仪器和用品:铁架台、铁圈、铁夹、三角架、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、滤纸、量筒、蒸发皿、圆底烧瓶。只用上述仪器和用品,不能进行的实验操作是
A.蒸发 B.萃取 C.过滤 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究SO2的性质,按如图Ⅰ所示装置进行实验。
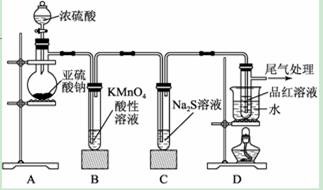

请回答下列问题:
(1) 装置A中盛放亚硫酸钠的仪器名称是__________;其中发生反应的化学方程式_______
_______________________。
(2)实验过程中,装置B、C中发生反应的现象分别是___________、___________,这些现象分别说明SO2具有的性质是___________和___________;
(3)该实验小组的甲、乙两位同学利用上述图Ⅱ装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①请写出实验室制取氯气的化学方程式:_______________________________________;
如何除去所制氯气中混有的氯化氢杂质:_______________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是(用离子方程式表示):_______
_______________________。
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 增大
,二氧化硫转化率 增大
,化学反应速率 减小
 (以上均填增大、减小或不变)。
(以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
增大了氧气的浓度
(用文字表达)。
(5)10min到15min的曲线变化的原因可能是 ab
(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是
A. 0.1mol/L的氢氧化钠溶液中含钠离子数目为0.1 NA
B.常温常压下,11.2L氮气所含的原子数目为NA
C.常温常压下,3.4 g NH3所含的原子数目为0.8NA
D. 78 g Na2O2与足量水反应转移的电子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com