
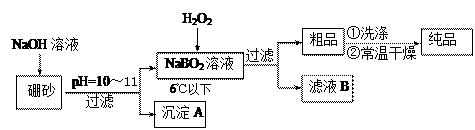

 体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。 72- + 2OH- = 4BO2- + H2O (2分)
72- + 2OH- = 4BO2- + H2O (2分)

科目:高中化学 来源:不详 题型:填空题
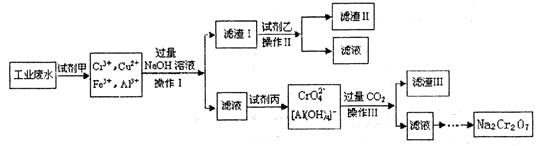
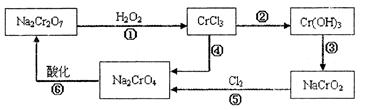
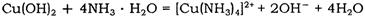
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
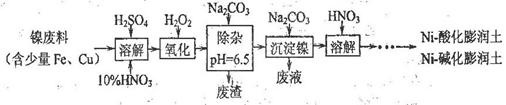
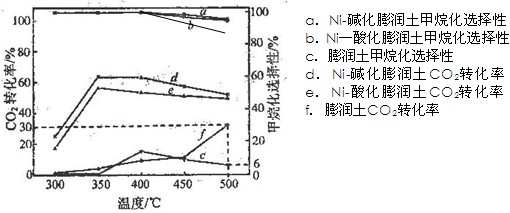
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
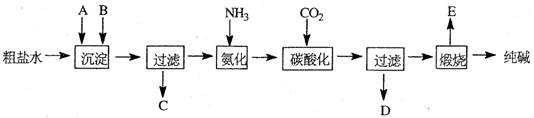
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 元素的质量分数为26.7%,其余为N、S。
元素的质量分数为26.7%,其余为N、S。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率 |
| B.合成氨工业对原料气进行压缩,可增大原料气的转化率 |
| C.硫酸工业中,采取通入适当过量的空气,以提高SO2的转化率 |
| D.硫酸工业中,在催化反应室安装热交换装置可利用SO3转化为H2SO4时放出的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
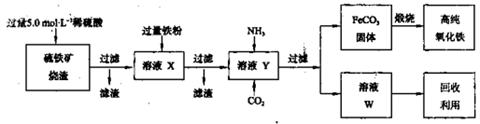
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com