
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:
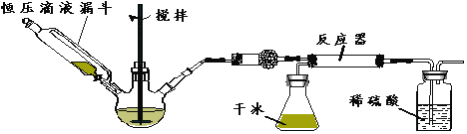
步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
【答案】 小于 NH3+CO2+H2O=NH4HCO3 固体氧化钙(生石灰)或固体氢氧化钠或碱石灰(写成化学式也给分) 不需净化和干燥处理 提供低温环境,提高转化率(或干冰升华吸收热量,提供低温环境使氨基甲酸铵的合成反应向正反应方向移动,提高了反应产率 ) 使氨水顺利滴下(使恒压滴液漏斗上部和三颈烧瓶气压相通,液体顺利滴下) 调节恒压滴液漏斗旋塞,减慢氨水滴加速度 产品易堵塞导管;或没有防倒吸装置,稀硫酸会倒吸;或反应器与稀硫酸之间没有防止水蒸气进入反应器的装置(任写一条,其它合理答案酌情给分)
【解析】(1)2NH3(g)+CO2(g)NH2COONH4(s),该反应为熵减的过程,若能自发进行,说明该反应为放热反应,即△H<0,故答案为:小于;
(2)水会和氨气、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;故答案为:NH3+CO2+H2O=NH4HCO3;
(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,故答案为:固体氢氧化钠或碱石灰;
②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率,故答案为:不需要干燥;提供低温环境,提高转化率;
③和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,故答案为:使氨水顺利滴下;
④反应后期,由于二氧化碳的气流下降,导致通入的二氧化碳气体减少,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水的滴加速度,故答案为:调节恒压滴液漏斗旋塞,减慢氨水的滴加速度;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸,故答案为:产品易堵塞导管,稀硫酸会倒吸。


科目:高中化学 来源: 题型:
【题目】计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
(4)①盐碱地因含较多的 ![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
②SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将SOCl2与FeCl36H2O混合并加热,可得到无水FeCl3 , 得到无水FeCl3的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)实验中,标准液KMnO4溶液应装在式滴定管中,因为 .
(2)实验中眼睛注视 , 直至滴定终点.判断到达终点的现象是 .
(3)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A. 滴定前仰视刻度,滴定后俯视刻度 .
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水 .
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4③用乙醚浸泡青蒿提取其中的有效成份青蒿素 ④除去食盐溶液中的泥沙。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏、蒸发B.萃取、蒸馏、分液、过滤
C.分液、蒸馏、萃取、过滤D.蒸馏、萃取、分液、蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
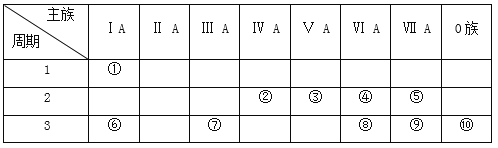
(1)在上述元素最高价氧化物对应水化物中,酸性最强的是_______________,碱性最强的是_____________,显两性的是_____________。(化学式)
(2)这些元素中,化学性质最不活泼原子的原子结构示意图为__________;气态氢化物中,最稳定的是_________(化学式),②③④⑤形成的氢化物中沸点最高的是_______(化学式)。
(3)①和④两种元素的原子按1:1组成的常见化合物的电子式为_____________。
(4)④、⑥、⑦、⑨的简单离子半径由大到小的顺序为______________________________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式_____________________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com