
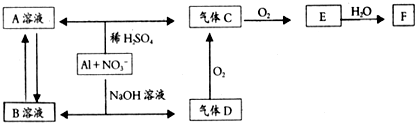

分析 Al在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和NO,碱性环境下生成偏铝酸盐和NH3,NH3催化氧化可以生成NO和水,NO可以和氧气反应生成NO2,故A为Al(NO3)3,B为偏铝酸盐,C为NO,D为NH3,E为NO2,F为HNO3,
(1)Al(NO3)3与偏铝酸盐反应生成氢氧化铝沉淀,氢氧化铝与硝酸反应生成铝离子和水;
(2)由铝离子制备氢氧化铝应该用弱碱;
(3)Al与NO3-在碱性条件下发生氧化还原反应,生成NO和偏铝酸根离子;用硫酸吸收氨气要用防倒吸装置;
(4)检验NH4+可以加碱,加热生成氨气,再用湿润的红色石蕊试纸检验氨气;
(5)根据反应Al+4HNO3=Al(NO3)3+NO↑+2H2O进行计算;
解答 解:Al在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和NO,碱性环境下生成偏铝酸盐和NH3,NH3催化氧化可以生成NO和水,NO可以和氧气反应生成NO2,故A为Al(NO3)3,B为偏铝酸盐,C为NO,D为NH3,E为NO2,F为HNO3,
(1)A为Al(NO3)3,B为偏铝酸盐,二者反应生成氢氧化铝沉淀,F为HNO3,氢氧化铝与硝酸反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(2)A为Al(NO3)3,由铝离子制备氢氧化铝应该用弱碱,否则会使生成的氢氧化铝沉淀溶解,所以将A转化为Al(OH)3所需的最佳试剂是NH3•H2O,故选c;
(3)Al与NO3-在碱性条件下发生氧化还原反应,该过程的离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3,生成的氨气用稀硫酸吸收时应防止倒吸,根据装置图可知,ac可以防止倒吸,b中应该用四氯化碳防倒吸,苯不能防倒吸,相当于将氨气直接排放到空气中,d中空瓶中左边的导管应该改成短管才可以防倒吸,故选ac,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3;ac;
(4)氨气与硝酸反应生成硝酸铵,检验NH4+的方法是:取少量D和F生成的盐溶液于试管中,加入氢氧化钠溶液,并且加热,如果生成的气体可以使湿润的红色石蕊试纸变蓝,说明溶液中存在NH4+,或者取少量D和F生成的盐溶液于试管中,加入氢氧化钠溶液,并且加热,用蘸有浓盐酸的玻璃棒靠近管口,有白烟生成,说明溶液中存在NH4+,
故答案为:取少量D和F生成的盐溶液于试管中,加入氢氧化钠溶液,并且加热,如果生成的气体可以使湿润的红色石蕊试纸变蓝,说明溶液中存在NH4+,或者取少量D和F生成的盐溶液于试管中,加入氢氧化钠溶液,并且加热,用蘸有浓盐酸的玻璃棒靠近管口,有白烟生成,说明溶液中存在NH4+;
(5)Al与NO3-在酸性条件下反应Al+4HNO3=Al(NO3)3+NO↑+2H2O,所以发生反应的Al与HNO3的物质的量之比是1:4,
故答案为:1:4.
点评 本题考查无机物的推断,为高频考点,侧重Al及其化合物转化的考查,把握发生的氧化还原反应推断各物质为解答的关键,注意铝在酸碱性不同条件下产物区别,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:多选题
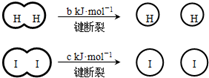 (a、b、c均大于零)
(a、b、c均大于零)| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(0H)3和O2可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-=CO2↑+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
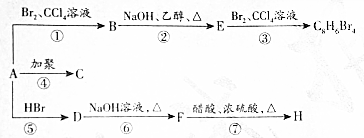
 ,D
,D ,E
,E .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O(消去反应).
+2NaBr+2H2O(消去反应). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr(取代反应).
+NaBr(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
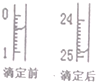 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
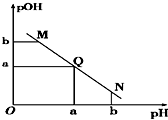 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )| A. | M点所示溶液导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度不相同 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的正盐化学式为BmAn | |
| B. | 该盐中存在着一定水解的离子,该离子水解方程式为:Bm++mH2O?B(OH)m+mH+ | |
| C. | 生成的盐为强酸弱碱盐 | |
| D. | HnA为弱酸,其第一步电离方程式为:HmA?Hm-1A-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com