
下列物质的检验方法正确的是
A.碘——淀粉
B.H+——酚酞
C.OH-——蓝色石蕊试纸
D.Cl-——盐酸酸化的硝酸银溶液
科目:高中化学 来源: 题型:阅读理解
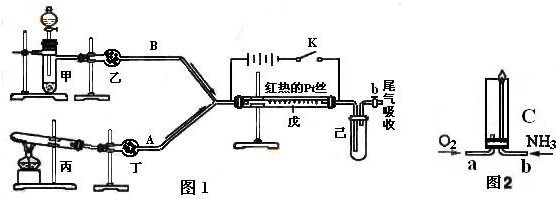
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
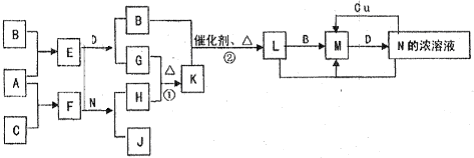


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届安徽省怀宁中学高三上学期开学水平检测考试化学试卷(带解析) 题型:填空题
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
回答下列问题:
(1) 已知: N2(g) + O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH ?905kJ/mol
?905kJ/mol
2H2(g) + O2(g)  2H2O(g) ΔH
2H2O(g) ΔH ?483.6kJ/mol
?483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g) ΔH ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)
 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是 _______ (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g) 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入NH3的物质的量 |
|
y |
NH3的物质的量 |
平衡常数K |
NH3的转化率 |
生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
|
|
0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
--------- |
|
实验2 |
5 |
5 |
40 |
25 |
---------- |
|
实验3 |
5 |
5 |
V2 |
0 |
----------- |
该实验的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反应C(s)+H2O(g)  H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。
①图中t4到t6段时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 。
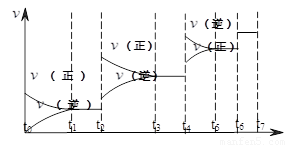
查看答案和解析>>
科目:高中化学 来源:2010届安徽省蚌埠市高三第三次教学质量检查理综试题 题型:填空题
今年初爆发的农夫山泉与统一饮料的“砒霜门事件”引起了人们对砷的生理作用的关注。砒霜是砷的氧化物,化学式为As2O3,砷在周期表中与氢、磷属于同族元素。该族元素与生物体的生命活动密切相关。被称为“生命之族”。如氮、磷是生物体中不可缺少的元素,在生命体中占有板其重要的地位。而砷和锑的某些化合物则有毒,所以中世纪的西方炼金术上曾分别用毒蛇和狼来作为砷和锑的符号。

|
(2)下列关于该元素的说法中正确的是 。
a.氮、磷、砷的电炙性依次减小
b.氮、磷、砷的气态氢化物分子的稳定性依次减弱
c.N-H、P-H、Aa—H键的健长依次增长,而键的极性依次降低
d.P4分子的空间的构壁为正四面体(如右图),P-P键之间的键角为109°28′
(3)氯是化肥中的主要元素,某种盐类物质是常见的氮肥成分,其中氮元素同时显示最高化合价和最低化合价,请写出该物质的化学式 。该化合物的组成元素中基态原子的第一电离徒最大的是 。
(4)“砒霜门事件”使不少人谈砷色变。实际上,砷是人体必需的微量元素,砷缺乏将导致生长海缓、骨骼异常等症状。只要控制砒霜的量,适当使用可以治病。
近代常用马氏试砷法检验砒霜的含量。其方法是用Zn、盐酸和试样混合,若试样中有As2O2存在,就会发生反应①:As2O3+Zn+HCl→X+ZnCl2+H2O(未配平)。在试管中加热X则发生反应②,可看到亮黑色的“砷镜”,并得到一种还原性气体单质。
写出反应①配平后的化学方程式 。若试样的质量为100g得到磷镜的质量为1.5g,反应①中转移电子的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com