
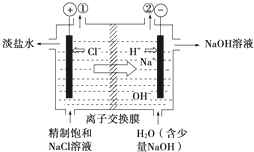
 如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )| A、装置中出口①处的物质是氯气,出口②处的物质是氢气 | ||||
| B、该离子交换膜只能让阳离子通过,不能让阴离子通过 | ||||
C、装置中发生反应的离子方程式为:2Cl-+2H+
| ||||
| D、该装置是将电能转化为化学能 |
| ||


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届广东省惠州市高三第一次调研考试理科综合化学试卷(带解析) 题型:填空题
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g) CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:
①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。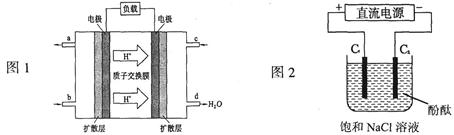
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第四次联考理综化学试卷(解析版) 题型:填空题
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图所示:

(1)该流程中可以循环的物质是??????????? 。
(2)电解法制碱的主要原料是饱和食盐水,由 于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式???? ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果??? 。
(3)如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是???? , E电极的名称是???? 。电解总反应的离子方程式为???????? 。
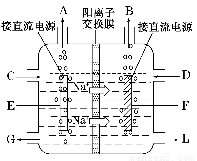
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为??????????? 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为??????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省惠州市高三第一次调研考试理科综合化学试卷(解析版) 题型:填空题
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g) CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:
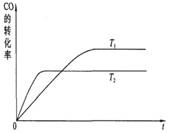
①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。

查看答案和解析>>
科目:高中化学 来源:2009年安徽省合肥一中高考化学冲刺最后一卷(解析版) 题型:填空题
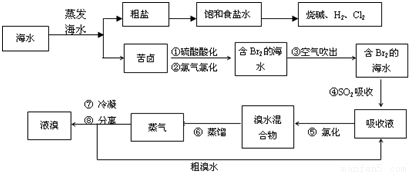
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com