
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10 (g,正丁烷)![]() CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
物质 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①书写热化学方程式时,要标明“同分异构体名称”,其理由是_______________________。
②上述反应中,△H1=______kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______(填代号)。
A.气体密度保持不变 B.[c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是________________。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
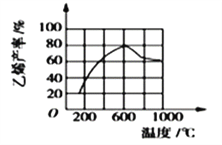
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________。
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为_________________________________________。
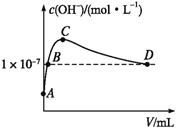
【答案】 同分异构体的能量不相等 +92 BD 升高温度 CD 0.15 4.5 C4H10+13CO32--26e-=17CO2+5H2O c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
【解析】分析:在相同条件下,同分异构体之间的生成热不同、所含的能量不同。反应热等于生成物的生成热总和减去反应物的生成热总和。根据反应物的状态和反应条件,判断气体的质量和体积是否变化,从而确定用于判断平衡状态的物理量是否为变量。催化剂的活性通常在适宜温度下最大,随着温度升高,副反应会增多。在恒温恒容条件下,气体的压强之比等于其物质的量之比。燃料电池中,燃料在负极上发生氧化反应。C点溶液中水电离出的OH-浓度最大,则C点对应的溶液为K2CO3溶液,因碳酸根离子可以发生水解而使溶液呈碱性。
详解:(1)①由表中数据可知,在相同条件下,同分异构体之间的生成热不同,故其所含的能量不同,因此,在书写热化学方程式时,要标明“同分异构体名称”。
②由生成热的定义可知,反应热等于生成物的生成热总和减去反应物的生成热总和,故上述反应中,△H1=52 kJ/mol +(-85 kJ/mol)-(-125 kJ/mol)==+92kJ/mol。
(2)①A.气体的质量和体积均不变,故气体密度保持不变; B.[c(C2H4)·c(C2H6)]/ c(C4H10)保持不变时就是该反应的化学平衡常数;C.反应热与平衡状态无关; D.正丁烷分解速率和乙烷消耗速率相等,表明正反应速率和逆反应速率相等。综上所述,表明该反应达到平衡状态的是BD。
②由于该反应是一个吸热反应,故升高温度可以同时提高反应速率和转化率。
(3)温度高于600℃时,随着温度升高,乙烯产率降低。A.该反应为吸热反应,故平衡常数随温度升高而增大;B.活化能不随温度变化而变化;C.催化剂活性通常在适宜温度下最大,高于其适宜温度后,其活性降低;D.随着温度升高,其可能发生的副反应增多,故副产物增多。综上所述,可能的原因是CD。
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍,则气体的总物质的量变为原来的1.75倍,即3.5mol,增加了1.5mol,所以各组分的变化量均为1.5mol。
①0~10min内乙烯的生成速率v(C2H4)=![]() 0.15mol·L-1·min-1。
0.15mol·L-1·min-1。
②上述条件下,该反应的平衡常数K=![]() 4.5。
4.5。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极,该燃料电池的负极上丁烷被氧化,电极反应式为C4H10+13CO32--26e-=17CO2+5H2O。
(6)由图可知,C点溶液中水电离出的OH-浓度最大,则C点对应的溶液为K2CO3溶液,因碳酸根离子可以发生水解而使溶液呈碱性,故其离子浓度大小关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】珍珠的主要成分是碳酸钙和水,其中所含的水是以极其细小粒子的形式(粒子直径大都在10-7m-10-9m之间)分散在固体碳酸钙中的。从分散系的组成分析,珍珠属于
A.溶液B.液溶胶C.浊液D.固溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠元素广泛存在于自然界,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列关于含钠元素物质的说法错误的是
A. “稻草变黄金”的过程中元素种类没有改变
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 治疗胃酸过多可以用NaHCO3,糕点生产也可以用NaHCO3
D. 金属钠放置空气中,最终会变成Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下:
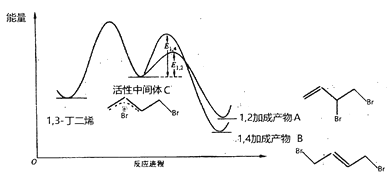
不同反应条件下,经过相同时间测得生成物组成如下表:
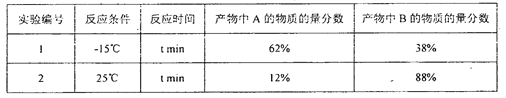
下列分析不合理的是
A. 产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B. 相同条件下由活性中间体C生成产物A的速率更快
C. 实验1测定产物组成时,体系己达平衡状态
D. 实验1在t min时,若升高温度至25℃,部分产物A会经活性中间体C转化成产物B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是
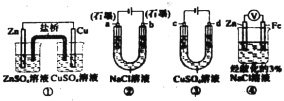
A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的作用,其合成路线如下:

已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应。
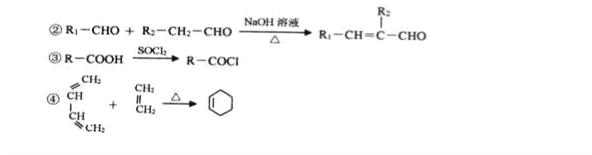
回答下列问题;
(1)E的结构简式为________________,G的名称为_____________。
(2)B中含有官能团的名称为__________________
(3)C→D的反应类型为_____________。
(4)写出B→C的化学反应方程式____________________________.F+H→M的化学反应方程式____________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。0.5molW可与足量的Na反应生成1gH2,且核磁共振氢谱显示为五组峰,符号以上条件的W的同分异构体共有__________种,写出其中一种的结构简式______________。
(7)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备OHC-CH=CH-CHO的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
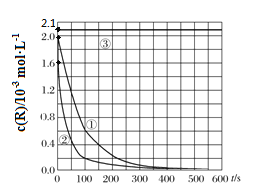
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N(![]() )可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:
)可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:

已知:R1、R2、R3、R4表示原子或原子团



请回答:
(1)A的官能团名称是______。
(2)B不能发生银镜反应,A→B的化学方程式是______。
(3)C的结构简式是______。
(4)D→F的反应类型是______,F→G的化学方程式是______。
(5)J的结构简式是______。
(6)K含有六原子环结构,K→L的化学方程式是______。
(7)G和L经过3步反应合成N,路线如下:
![]()
结合中间体L的合成路线,写出下列物质的结构简式:
中间产物1:______,中间产物2:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层且浮于水面的是( )
①苯②乙酸乙酯③乙醇④乙酸⑤甲苯⑥硝基苯
A. ①②③B. ①③⑤C. ①②⑤D. ①②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com