
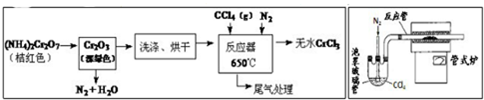
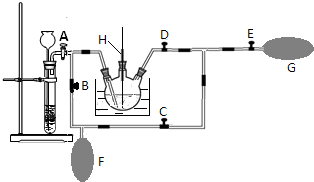
分析 根据流程图知,重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)、氮气和水,然后洗涤、烘干得到Cr2O3,在加热条件下,在反应器中发生反应Cr2O3+3CCl4═2CrCl3+3COCl2,三氯化铬易升华,在高温下能被氧气氧化,为防止三氯化铬被氧化,通入氮气,且充入的氮气能使反应物进入管式炉中进行反应;最后得到无水三氯化铬,
(1)三氯化铬碱性条件下被H2O2氧化为铬酸根,根据电荷守恒和元素守恒书写离子方程式;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量;
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿;步骤②中通入氮气,可以将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化,据此答题;
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl;
(5)①根据溶液的配制和氧化还原滴定操作可知所需要的仪器;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差;
③由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.
解答 解:(1)三氯化铬碱性条件下被H2O2氧化为铬酸根,根据电荷守恒和元素守恒可知离子方程式为2Cr3++3H2O2+10OH-=2CrO42-+8H2O,
故答案为:2Cr3++3H2O2+10OH-=2CrO42-+8H2O;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度,
故答案为:水浴加热(并用温度计指示温度);
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,故操作顺序为:⑥→③→②→④→⑤→①,步骤②中通入氮气,可以将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化,
故答案为:②→④→⑤→①;将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化;
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl,反应方程式为COCl2+2C2H5OH→C2H5OCOC2H5+2HCl,
故答案为:COCl2+2C2H5OH→C2H5OCOC2H5+2HCl;
(5)①实验除用移液管、碘量瓶、烧杯外,还需要的玻璃仪器有:250ml容量瓶、碱式滴定管,
故答案为:250ml容量瓶、碱式滴定管;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差,
故答案为:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差;
③令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算,
2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+) 0.0250mol/L×0.024L
故n(Cr3+)=0.0250mol/L×0.024L×$\frac{1}{3}$,所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.024L×$\frac{1}{3}$×$\frac{250mL}{25mL}$=0.002mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.002mol,所以样品中m(CrCl3)=0.002mol×158.5g/mol=0.317g,故样品中无水三氯化铬的质量分数为$\frac{0.317g}{0.33g}$×100%=96.1%.
故答案为:96.1%.
点评 本题考查学生对的实验方案原理的理解与评价、物质组成含量的测定、滴定应用、化学计算等,题目难度较大,理清实验原理是关键,是对学生综合能力想考查,需要学生具备扎实的基础知识.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| D. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
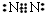 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 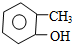 邻甲基苯酚 邻甲基苯酚 | |
| D. | 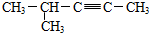 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 含氧酸可作氧化剂而无氧酸则不能 | |
| C. | 金属原子失电子数越多,其还原性越强 | |
| D. | 金属单质在反应中只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
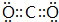
 ,用电子式表示化合物 C2D 的形成过程
,用电子式表示化合物 C2D 的形成过程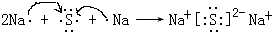 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是具有Cn(H2O)m通式的物质 | |
| C. | 淀粉是一种白色粉末,本身没有甜味 | |
| D. | 葡萄糖是一种单糖的主要原因是含有醛基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com