

分析 (1)过滤分离不溶性固体和液体;
(2)依据氢氧化钙和平衡状态下的镁离子结合生成氢氧化镁沉淀,促进平衡右移分析;
(3)“除杂”环节中主要是除去钙离子,但不能引入新的杂质,调节溶液PH呈中性,除去加入的碳酸钾,得到较纯净的硫酸钾,需要加入硫酸调节;
(4)实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥;
(5)以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)平衡常数概念写出计算式,依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算分析.
解答 解:(1)分离不溶性固体和液体用过滤,故答案为:过滤;
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移钙离子增多,饱和溶液中析出氢氧化钙,增多K+,故答案为:氢氧根与镁离子结合使平衡向右移动,钾离子变多;
(3)“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾,故答案为:K2CO3;中性;
(4)实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到,故答案为:蒸发浓缩、冷却结晶;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=$\frac{c(S{O}_{4}{\;}^{2-)}}{c(CO{\;}_{3}{\;}^{2-})}$=$\frac{Ksp(CaSO{\;}_{4})}{Ksp(CaCO{\;}_{3})}$=$\frac{4.90×10{\;}^{-5}}{2.80×10{\;}^{-9}}$=1.75×104,故答案为:1.75×104.
点评 本题考查了沉淀溶解平衡的影响因素分析判断,流程分析,分离提纯的方法应用,图象分析判断方法,平衡常数的计算应用,沉淀转化的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 原子序数:b>a>c>d | ||
| C. | 离子的还原性:cCn->dD(n+1)- | D. | 离子的氧化性:aAn+>bB(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: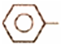 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 香兰素的化学式为C8H8O3 | |
| B. | 能与Na2CO3和NaOH溶液反应 | |
| C. | 1 mol香兰素只能与含1 mol Br2的溴水反应 | |
| D. | 能使酸性高锰酸钾溶液褪色的官能团有羟基和醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 | |
| C. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可供人类利用的淡水资源非常丰富 | |
| B. | 我国有多条大江大河和众多的湖泊,所以属于富水国家 | |
| C. | 每人每天约需2.5 kg水,加之人口急剧增加,地球上的淡水对满足人们的生活用水已很紧张 | |
| D. | 海水中含有大量的盐,人类无法从中提取淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收并氧化水果释放出的乙烯 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com