
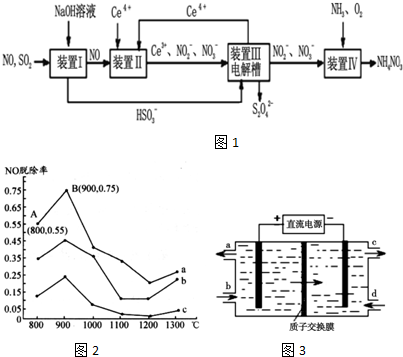
分析 Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率=$\frac{一氧化氮脱硫的变化}{变化时间}$×100%;
②NH3与NO的物质的量的比值越大,NO脱除率越大;
(2)已知在25℃,101kPa时:
①N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
②2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
③N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1,用NH3脱除NO的化学方程式为4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1),可根据该寺定律,将3×②-2×①-3×③可得热化学方程式;
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,以此解答.
解答 解:Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率=$\frac{(75%-55%)×6×1{0}^{-4}}{0.8s}$=1.5×10-4mg/(m3•s),
故答案为:1.5×10-4;
②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,
故答案为:3:1;NH3与NO的物质的量比值越大,NO的脱除率越大;
(2)已知在25℃,101kPa时:
①N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
②2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
③N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1,用NH3脱除NO的化学方程式为4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1),可根据该寺定律,将3×②-2×①-3×③可得热化学方程式4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=-(3Q2-2Q1+3Q3)KJ/mol,
故答案为:4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=-(3Q2-2Q1+3Q3)KJ/mol;
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3-+4H+,故答案为:3Ce4++NO+2H2O═3Ce3++NO3-+4H+;
(4)阴极发生还原反应,电极方程式为2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(5)amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3,S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,
由化合价升降总数相等可知4x+a=3b,x=$\frac{3b-a}{4}$,则氧气的体积为$\frac{3b-a}{4}$mol×22.4L/mol=5.6(3b-a)L,
故答案为:5.6(3b-a).
点评 本题考查了无机化工生产流程图,为高频考点,涉及氧化还原反应、计算、电化学等知识,综合性强,侧重分析、计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
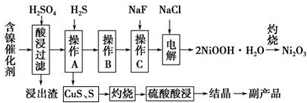 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
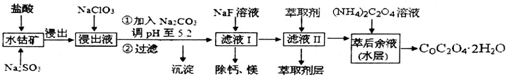
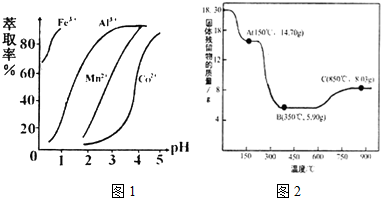
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应可表示为:2A(g)+B(g)?C(g)△H<0 | |
| B. | t℃时该反应的平衡常数K=6.25 | |
| C. | 当容器中气体密度不再变化时,该反应达到平衡状态 | |
| D. | t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,已知:
25℃时,已知:| A. | W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11 的溶液中:CO32-+H2O HCO3-+OH- K≈1.8×l0-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
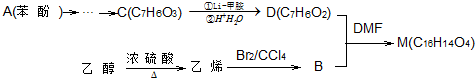
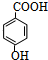

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
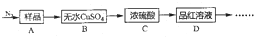
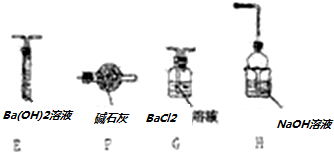
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com