
【题目】已知A为金属单质,如图所示流程中的各步反应的最后生成物E是白色沉淀。
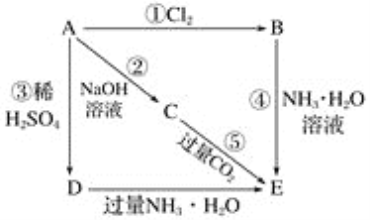
(1)写出下列物质的化学式。
A:________,B:________,C:________,D:________,E:________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式:_____________________________。
②A的氧化物与NaOH溶液反应的离子方程式:__________________________。
③由C生成E过程的化学方程式:_____________________________。
【答案】 Al AlCl3 NaAlO2 Al2(SO4)3 Al(OH)3 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Al2O3+2OH-===2AlO![]() +H2O NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓
+H2O NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓
【解析】已知A为金属单质,能与氢氧化钠溶液和稀硫酸均反应,则A是铝,所以B是氯化铝,C是偏铝酸钠,D是硫酸铝,E是氢氧化铝。
(1)根据以上分析可知A~E的化学式分别是Al、AlCl3、NaAlO2、Al2(SO4)3、Al(OH)3。(2)①铝与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O===2NaAlO2+3H2↑。②A的氧化物氧化铝与NaOH溶液反应的离子方程式为Al2O3+2OH-===2AlO2-+H2O。③由C生成E的过程中CO2过量,因此反应的化学方程式为NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓。


科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 将氧化钠溶于水中:O2-+H2O=2OH-
C. 纯碱溶液中滴加少量盐酸:CO![]() +H+===HCO
+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为四种短周期元素,原子序数依次增大.其中W元素的原子核内只有1个质子;X是化合物种类最多的元素;Y原子的最外层电子数是次外层电子数的3倍;Z是短周期中最活泼的金属元素.
(1)X的原子结构示意图为 .
(2)XY2与Z2Y2反应的化学方程式 .
(3)W、Y、Z三种元素可组成一种离子化合物,其中阳离子所含电子数与阴离子所含电子数之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,下列说法正确的是( )
A.水的电离程度不变
B.pH值变大
C.稀释过程中,所有离子浓度均变小
D.稀释过程中Kw逐渐变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,一定量的某有机物和过量的金属钠反应产生a L氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体b L,若a=b,则该有机物可能是( )
A.HOOC﹣COOH
B.HOOC﹣CH2CH2OH
C.HOCH2﹣CH2OH
D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 14CO2与碳在高温条件下发生反应:14CO2+C2CO,达到平衡后,平衡混合物中含14C的粒子有( )
A.14CO2
B.14CO2、14CO
C.14CO2、14CO,14C
D.14CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( ) 
A.1:2
B.3:2
C.5:2
D.7:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Na2SO3还原MnO4-,如果还原含有2.4×10-3 mol MnO4-的溶液时,消耗18 mL0.2mol/L的Na2SO3 溶液,则Mn元素在还原产物中化合价为()
A. +1 B. +2 C. +4 D. +5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com