
| A. | 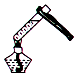 加热液体 | B. |  加入固体粉末 | C. |  倾倒液体 | D. |  尾气吸收 |
分析 A.试管中液态体积不能超过试管容积的$\frac{1}{3}$;
B.应该先将试管横放,然后用药匙将固体粉末送入试管底部;
C.倾倒液态时需要做到:瓶塞倒放、标签向手心、瓶口对试管口、试管倾斜;
D.氯化氢气体极易溶于水,稀释HCl气体时必须防止倒吸,图示装置中易发生倒吸现象.
解答 解:A.给试管中液态加热时,试管中液态体积不能超过试管容积的$\frac{1}{3}$,故A错误;
B.向试管中加入固体粉末时,应该先将试管横放,图示操作方法不合理,故B错误;
C.倾倒液体时,瓶塞要倒放,试管稍稍倾斜,试管口与瓶口要紧靠,药品瓶标签必须向着手心,图示操作合理,故C正确;
D.由于HCl气体极易溶于水,稀释氯化氢时必须使用防倒吸装置,图示装置中会发生倒吸现象,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及液态加热、倾倒、药品取用及尾气吸收等操作方法,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同


| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 等物质的量的甲烷和一氧化碳所含的分子数前者大于后者 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如改变体系温度,体系颜色一定发生变化 | |
| B. | 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移 | |
| C. | 继续充入HI气体,则HI的转化率将减小 | |
| D. | 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com