
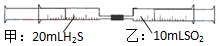
 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )| A. | 有淡黄色固体生成 | B. | 有无色液体生成 | ||
| C. | 气体体积缩小 | D. | 最终约余15mL气体 |
分析 气体在同温同压下测定,体积之比等于物质的量之比,而H2S和SO2反应2H2S+SO2=3S+2H2O,析出浅黄色固体,乙中气体体积减少,活塞向内移动,由此分析解答.
解答 解:20mLH2S推入含有10mLSO2,所以两者的物质的量之比为2:1,由反应2H2S+SO2=3S+2H2O可知,两者恰好完全反应生成淡黄色固体和液态水,
A、有淡黄色固体生成,故A正确;
B、水无色液体水生成,故B正确;
C、最后生成单质硫和液态水,所以气体体积缩小,故C正确;
D、最终无气体,故D错误;
故选D.
点评 本题考查了元素及其化合物的知识,涉及硫的化合物的性质,综合性教强,需学习该阶段知识时掌握相关的反应方程式,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | IA族金属元素是同周期中金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
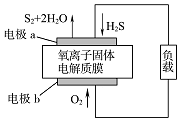 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M的分子式为C9H10O4 | |
| B. | M与浓溴水既能发生取代反应,又能发生加成反应 | |
| C. | 一定条件下,1 mol M最多能与3molH2发生反应 | |
| D. | M能分别与Na、NaOH、NaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 |  |
| A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
| B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
| C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
| D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2有氧化性,能用于雕刻电路板 | |
| B. | 金刚石是自然界中硬度最大的物质,不与氧气发生反应 | |
| C. | 明矾加入水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | SiO2不与强酸反应,可用石英器皿盛装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:H2O<H2S<H2Se | |
| B. | 降温有利于Se与H2反应生成H2Se | |
| C. | O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1 | |
| D. | 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol H3O+中含有的电子数目为11NA | |
| B. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数目为0.04NA | |
| C. | 28g聚乙烯含有的碳原子数目为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com