
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 浓硫酸不慎滴到皮肤上,先用较多的水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| D. | 除去粗盐中的硫酸盐应加入BaCl2溶液,离子反应为Ba2++SO42-═BaSO4↓ |
分析 A、三层滤纸较厚,过滤操作时不易被玻璃棒捅破;
B、向试管内滴加液体时胶头滴管应竖直悬空;
C、浓硫酸遇水稀释放热;
D、除去粗盐中的硫酸盐应加入BaCl2溶液.
解答 解:A、三层滤纸较厚,过滤操作时不易被玻璃棒捅破,故A正确;
B、向试管内滴加液体时胶头滴管应竖直悬空,不能紧贴试管内壁,故B错误;
C、浓硫酸遇水稀释放热,故应先用干抹布抹去,然后用大量水冲洗,最后图上碳酸氢钠溶液,故C错误;
D、除去粗盐中的硫酸盐应加入BaCl2溶液,通过反应Ba2++SO42-═BaSO4↓来除去硫酸根,故D正确.
故选BC.
点评 本题考查化学实验中有许多的实验注意事项,这些都涉及到化学实验的安全和基本操作.学习的时候要切记,题目较简单.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 9.1% | C. | 1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
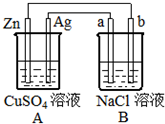 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{36V}$mol/L | B. | $\frac{a}{18V}$mol/L | C. | $\frac{a}{54V}$mol/L | D. | $\frac{a}{27V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物(括号内为杂质) | 除杂试剂(填序号) | 反 应 离 子 方 程 式 |
| ①Cu (CuO) | ||
| ②NaBr (NaI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com