
【题目】按F、Cl、Br、I顺序递增的是
A. 外围电子B. 原子半径C. 电负性D. 第一电离能
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在周期表中的位置如图。下列说法正确的是
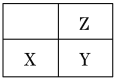
A. Z元素的最高化合价一定大于X元素
B. 三种元素原子半径由高到低的顺序一定是Y>X>Z
C. 若它们的原子最外层电子数之和为11,则X为金属元素
D. 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
![]()
(1)已知: 由苯合成锦纶的过程中需生成1,6—己二酸(HOOCCH2CH2CH2CH2COOH),则由苯合成1,6—己二酸的流程中各步反应类型为:______、_______、_______、_______。
(2)已知:
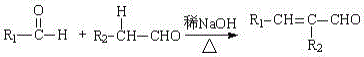 (R,R' 为烃基或氢)
(R,R' 为烃基或氢)
苯甲醛和乙醛混合经信息中反应可以得到C9H8O,其结构简式为:______;但在此体系中还检测出了含四个碳原子和十一个碳原子有机物,写出含四个碳原子的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:________________,核外有______种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序______________________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_________________________________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为______________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为______________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是__________。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率:干冰_______冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因___________。
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是:将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如右图所示。下列表述不正确的是
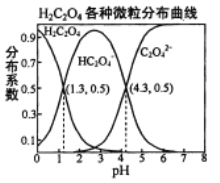
A. HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. 常温下HF的K=1×10-3.4,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/L NaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是

A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
D.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com