
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
分析 A.不同物质表示的正、逆速率之比等于其化学计量数之比,反应到达平衡;
B.该反应可实现燃煤烟气中硫的回收,再根据原子守恒进行判断;
C.根据v=$\frac{△c}{△t}$计算v(SO2),再利用速率之比等于其化学计量数之比计算v(X);
D.3s时处于平衡状态,计算CO浓度变化量,CO转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%.
解答 解:A.应是当2v(SO2)正=v(CO)逆时,该反应达到了平衡状态,故A错误;
B.该反应可实现燃煤烟气中硫的回收,根据原子守恒可知Y为S、X为CO2,故B正确;
C.前1s内v(SO2)=$\frac{1mol/L-0.5mol/L}{1s}$=0.5mol/(L.s),速率之比等于其化学计量数之比,v(X)=2v(SO2)=1mol/(L.s),故C正确;
D.3s时处于平衡状态,CO浓度变化量为(4-2)mol/L=2mol/L,CO转化率=$\frac{2mol/L}{4mol/L}$×100%=50%,故D正确,
故选A.
点评 本题考查化学平衡计算、反应速率计算、平衡状态判断等,难度不大,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
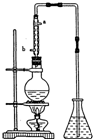 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)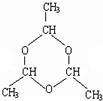 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+H2O?NH3•H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com