
下列说法中,不正确的是
A.H、D、T互为同位素
B.NaHCO3、HCOONa均含有离子键和共价键
C.常温常压下,22.4 L CCl4含有NA个CCl4分子
D.常温下,23 g NO2含有NA个氧原子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
Ni2+(高浓度)>H+>Ni2+(低浓度)
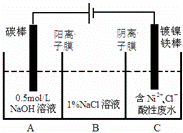
|
| A. | 碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O |
|
| B. | 电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
|
| C. | 为了提高Ni的产率,电解过程中需要控制废水pH |
|
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
解析下列事实的离子方程式不正确的是
A. 氨水使湿润的红色石蕊试纸变蓝:
B. 工业上用过量的溶液吸收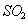 :
: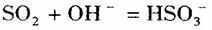
C. 用烧碱溶液清洗铝表面的氧化膜: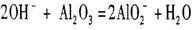
D. 用石灰乳吸收泄漏的氯气: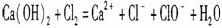
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:
N2H4(l)+O2(g)====N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:
2C(石墨,s)+O2(g)====2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+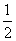 O2(g)====H2O(l) ΔH=-286 kJ·mol-1,
O2(g)====H2O(l) ΔH=-286 kJ·mol-1,
则:2H2O(l)====2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
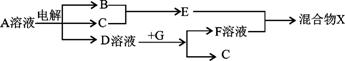
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
若把长式元素周期表原先的副族、主族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第16列元素均为非金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0,反应吸热时,ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表中17号元素的原子37Cl和6号元素的原子13C的原子相比较,前者的下列数据是后者的4倍的是( )
A.中子数 B.最外层电子数
C.电子层数 D.次外层电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com