
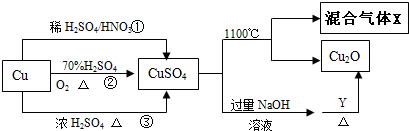
分析 途径①Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
途径②Cu与氧气、硫酸反应,2H2SO4+O2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,其离子方程式为:2Cu+O2+4H+=Cu2++2H2O;
途径③2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑++2H2O;
硫酸铜高温分解生成Cu2O和混合气体,硫酸铜与氢氧化钠反应生成氢氧化铜,在加热条件下氢氧化铜与含有醛基的物质反应生成Cu2O,
(1)根据离子方程式中氢离子与硝酸根离子的物质的量关系分析;
(2)根据以上分析没有污染性气体生成的符合绿色化学思想;
(3)硫酸铜分解生成Cu2O与氧气、SO2、SO3,依据电子守恒分析;
(4)X有三种物质组成,根据元素守恒可知X为O2、SO2、SO3,结合原子守恒和得失电子守恒书写方程式;由得失电子守恒分析;
(5)Y为含醛基的物质,含碳原子最少的是甲醛,碱性条件下甲醛与氢氧化铜反应生成碳酸钠、氧化亚铜和水.
解答 解:途径①Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
途径②Cu与氧气、硫酸反应,2H2SO4+O2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,其离子方程式为:2Cu+O2+4H+=Cu2++2H2O;
途径③2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑++2H2O;
硫酸铜高温分解生成Cu2O和混合气体,硫酸铜与氢氧化钠反应生成氢氧化铜,在加热条件下氢氧化铜与含有醛基的物质反应生成Cu2O,
(1)Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2;
故答案为:3:2;Cu+2NO3-+8H+=Cu2++2NO↑+4H2O;
(2)途径②的优点:制取等质量胆矾需要的硫酸少、没有污染性气体产生,更好地体现了绿色化学思想,故答案为:②;
(3)硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、氧元素化合价都降低,没有元素化合价升高;
故答案为:否;生成物就只有Cu2O、SO2和SO3三种物质,铜和硫元素化合价都降低,得到电子,而没有元素失去电子不可能;
(4)X有三种物质组成,根据元素守恒可知X为O2、SO2、SO3,则化学方程式:2CuSO4$\frac{\underline{\;加热\;}}{\;}$Cu2O+SO2↑+SO3↑+O2↑;若1mol CuSO4分解生成0.75molO2,则失去的电子为3mol,那么1molCu得到1mol电子,1molS得到2mol电子都转化为SO2就不可能有SO3生成了;
故答案为:2CuSO4$\frac{\underline{\;加热\;}}{\;}$Cu2O+SO2↑+SO3↑+O2↑;不可能;若1mol CuSO4分解生成0.75molO2,则失电子为3mol,而1molCu得到1mol电子,1molS得到2mol电子都转化为SO2没有SO3生成;
(5)Y为含醛基的物质,含碳原子最少的是甲醛,碱性条件下甲醛与氢氧化铜反应生成碳酸钠、氧化亚铜和水,其反应的方程式为HCHO+4Cu(OH)2+2NaOH$\stackrel{△}{→}$Na2CO3+2Cu2O+6H2O;
故答案为:HCHO+4Cu(OH)2+2NaOH$\stackrel{△}{→}$Na2CO3+2Cu2O+6H2O.
点评 本题考查了物质的制备,解题的关键是掌握物质的性质,解答时要依据题干提供信息,结合相关知识细心分析解答,题目难度中等.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2 | B. | 0.5molNH3 | ||
| C. | 6.02×1023个的CH4分子 | D. | 29.4gH3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
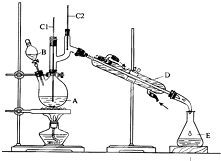 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
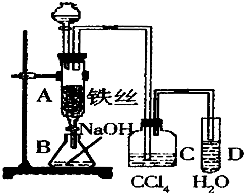 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.
高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.| 实验编号 | pH | 投料比(高铁酸钾与苯酚的质量比) | T/K | Fe3+ | 实验目的 |
| Ⅰ | 4 | 10:1 | 298 | 0 | 参照实验 |
| Ⅱ | 4 | 8:1 | 298 | 0 | |
| Ⅲ | 探究温度对该降解反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe0溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 明矾溶液中滴加过量氨水:Al3++3NH3.H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | 漂白粉溶液中通入S02:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| D. | 小苏打溶液中加足量澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com