
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)![]() NH3(g)
NH3(g)![]() NH4Cl(aq)
NH4Cl(aq)
B. Fe(s)![]() FeCl2(s)
FeCl2(s)![]() Fe(OH)2(s)
Fe(OH)2(s)
C. MgO(s)![]() MgSO4(aq)
MgSO4(aq)![]() Mg(s)
Mg(s)
D. S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
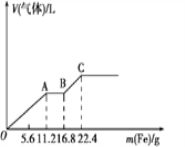
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
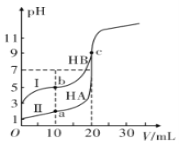
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
(4)已知温度时,0.1 mol·L-1的某一元酸HB在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=________。
②HB的电离平衡常数K=________。
③由HB电离出的c(H+)约为水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是_____(填物理变化、化学变化);
(2)从海水中可获得大量的氯化钠,精制盐水时要除去SO42﹣、Mg2+、Ca2+,可依次加入稍过量的溶液是NaOH、_____、_____(写化学式),过滤后,再加入盐酸,蒸发溶液后可得到较纯净的氯化钠。
(3)食盐水能导电,是因为NaCl能电离出Na+和Cl﹣,它们的电子式分别为_____和_____,工业上利用电解饱和食盐水可制得重要化工产品,该反应的化学方程式_____
(4)氢气用途广泛,完全燃烧4g氢气就能烧开一壶水,在标准状况下,这些氢气的体积是_____L,含_____个氢原子。
(5)将制得的氯气通入石灰乳中可以制得漂粉精,其中有效成份为_____(写名称),漂粉精可用于游泳池中水的消毒,原因是(用化学方程式表示):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A. c(H+)=c(OH-)=10-6 mol·L-1的溶液 B. c(H+)=1×10-7mol·L-1的溶液
C. pH=7的溶液 D. 酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温时Cu(NO3)2的水溶液的pH _____7(填“>”、“=”、“<”),原因是(用离子方程式表示):________________________;
(2)氯化铝水溶液呈____性 ,原因是(用离子方程式表示):_________________。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________ 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为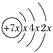 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
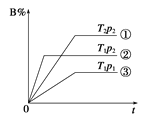
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com