
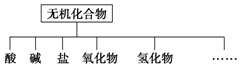
 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
分析 (1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树;
(2)酸电离出的阳离子全部是氢离子的化合物;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水;
(4)双氧水分解生成氧气和水;
(5)二氧化碳和氢氧化钠反应生成碳酸钠和水;
(6)反应Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,1mol铜失去2mol电子,做还原剂,2mol硝酸得电子被还原,做氧化剂;19.2g铜的物质的量为0.3mol,根据1molCu~2mol硝酸可求出当0.3mol铜反应时被还原的硝酸的物质的量.
解答 解:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,故答案为:树状分类法;
(2)酸电离出的阳离子全部是氢离子的化合物,如H2SO4;碱电离出的阴离子全部为氢氧根离子,如NaOH;盐电离出得阳离子为金属离子,阴离子为酸根离子,如K2SO4,
故答案为:②H2SO4;③NaOH;⑥K2SO4;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(4)双氧水分解生成氧气和水,化学方程式为:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑;
(5)二氧化碳和氢氧化钠反应生成碳酸钠和水,离子方程式为:2OH-+CO2=CO32-+H2O,故答案为:2OH-+CO2=CO32-+H2O;
(6)反应Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,1mol铜失去2mol电子,做还原剂,4mol硝酸中的2mol硝酸得电子被还原,做氧化剂,故用单线桥表示电子得失方向和数目为 ;19.2g铜的物质的量为0.3mol,设备还原的硝酸的物质的量为xmol,则有:1molCu~2molHNO3,
;19.2g铜的物质的量为0.3mol,设备还原的硝酸的物质的量为xmol,则有:1molCu~2molHNO3,
0.3mol xmol
则有:$\frac{1}{0.3}=\frac{2}{x}$
解得x=0.6mol,即被还原的硝酸为0.6mol.
而由于铜反应后变为+2价,故0.3mol铜反应后转移0.6mol电子,即0.6NA个.
故答案为: ;硝酸;铜;0.6mol;0.6NA.
;硝酸;铜;0.6mol;0.6NA.
点评 本题考查了化学方程式和离子方程式的书写以及氧化还原反应中得失电子的有关计算,难度不大,应注意单线桥的标示方法.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
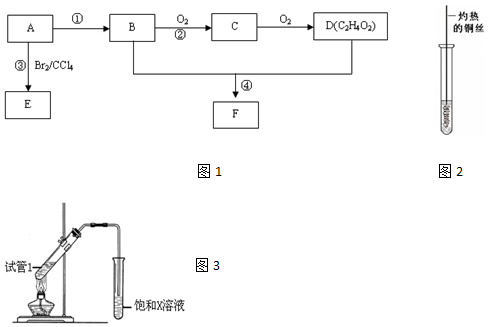
 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com