
| A. | “人造太阳”核心组件之一为高纯铍,可通过H2还原BeO制铍 | |
| B. | 富脂食品包装时,放入活性铁粉等抗氧剂,以防止油脂氧化变质 | |
| C. | 煤气化直接制烯烃研究取得重大突破,煤汽化可同时获得焦炭 | |
| D. | 俄罗斯发生了严重的假酒事件,假酒中的甲醇与乙二醇互为同系物 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
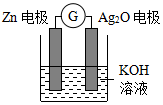 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
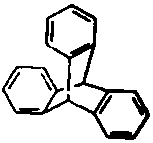
| A. | 三蝶烯是苯的同系物 | |
| B. | 三蝶烯能发生取代反应 | |
| C. | 三蝶烯的一氯代物有6种 | |
| D. | 三蝶烯分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2 mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com