
将6.0 g纯铁粉加入200 mL Fe2(SO4)3和CuSO4的混合液中,充分反应得到200 mL 0.50 mol·L-1 FeSO4溶液和5.2 g固体沉淀物.计算:
(1)反应后生成铜的质量.
(2)加入铁粉前Fe2(SO4)3溶液的物质的量浓度.
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:内蒙古赤峰二中2010-2011学年高一上学期期末考试化学试题 题型:022
将
1.4 g纯铁粉放入80 ml 1 mol/L的稀HNO3中,反应停止后,生成的硝酸盐的成分是________其物质的量是________
被还原的硝酸的质量是________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应后生成铜的质量是多少?
(2)加入铁粉前Fe2(SO4)3溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
将6.0 g纯铁粉加入200 mL Fe2(SO4)3和CuSO4的混合液中,充分反应得到200 mL ?0.50 mol·L-1 FeSO4溶液和5.2 g固体沉淀物。计算:
(1)反应后生成铜的质量是多少?
(2)加入铁粉前Fe2(SO4)3溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二第一阶段考试化学试卷(解析版) 题型:填空题
(14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
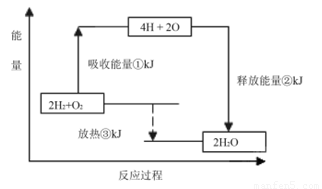
① kJ ② kJ ③ kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com