
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A. | KCl | CaCl2 | Na2CO3溶液、盐酸 | 过滤 |
| B. | CH3CH2OH | CH3COOH | CaO | 蒸馏 |
| C. | NaCl | NH4Cl | NaOH | 蒸干 |
| D. | N2 | O2 | 铜网 | 加热 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤 |
| B.Fe2+ (Fe3+),还原铁粉,过滤 |
| C.NaHCO3溶液(Na2CO3);通入过量的CO 2 |
| D.CO2(HCl),饱和溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
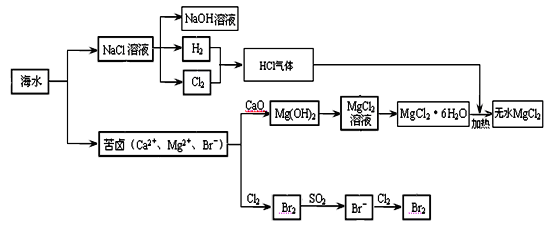
 MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.区别苯和甲苯 |
| B.检验硫酸铁溶液中是否有硫酸亚铁 |
| C.检验CH2=CHCHO中含碳碳双键 |
| D.区别SO2和CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
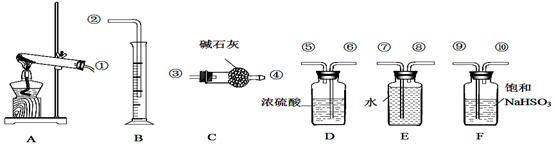
| 实验 小组 | 称取无水CuSO4的质量/g | 仪器C增加的质量/g | 量筒中水的体积折算标准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
 ,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)
,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | 溴苯(溴) | 氢氧化钠 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠 | 分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com