
【题目】用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
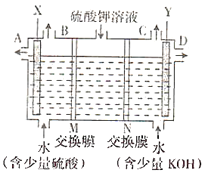
(1)X极与电源的________(填“正”或“负”)极相连。氢气从________(填“B”或“C”)口导出。
(2)已知离子交换膜只允许某类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得氧气5.6L(标准状况),则生成氢氧化钾的质量是________。
【答案】正 C 阴离子 56g
【解析】
电解的目的是利用电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾,分析图中信息,可得出左池应制取硫酸,右池应制取KOH,则X电极应为阳极,在此电极H2O失电子生成O2和H+;Y电极应为阴极,在此电极H2O得电子生成H2和OH-。
(1)从以上分析知,X极为阳极,与电源的正极相连。氢气由水得电子产生,即从阴极Y产生,则从C口导出。答案为:正;C;
(2)因为左池生成硫酸,则中间池中的SO42-通过离子交换膜进入左池,则M为阴离子交换膜。答案为:阴离子;
(3)若制得氧气5.6L(标准状况),n(O2)=![]() =0.25mol,n(e-)=4n(O2)=1mol,阴极电极反应式为2H2O+2e-==2OH-+H2↑,则生成氢氧化钾的质量是1mol×56g/mol=56g。答案为:56g。
=0.25mol,n(e-)=4n(O2)=1mol,阴极电极反应式为2H2O+2e-==2OH-+H2↑,则生成氢氧化钾的质量是1mol×56g/mol=56g。答案为:56g。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)![]() cQ(g)。气体M、N、Q的物质的量随时间的变化如右图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如右图所示,则下列叙述正确的是( )

A. 体系平衡时与反应起始时的压强之比为3∶2
B. 平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50%
C. 若开始时向容器中充入2 mol M和1 mol N,达到平衡时,M的体积分数小于50%
D. 在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛和苯甲醛互为同系物
B. 肉桂醛能发生加成反应、取代反应和加聚反应
C. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
D. 1mol肉桂醛分子在一定条件下最多与5mol氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钾主要用作食品膨松剂,也用于彩色电视机工业。
(1)K2CO3溶液呈________(填“酸”或“碱”)性,其原因是_________(用离子方程式表示);请设计一个简单的实验方案证明上述观点:__________。
(2)下列有关0.1 mol·L-1的K2CO3溶液的叙述错误的是________(填标号)。
A.c(K+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(3)室温下将0.1 mol·L-1的K2CO3溶液与0.1 mol·L-1的盐酸等体积混合,所得溶液中各离子的浓度由大到小的顺序为_________________。
(4)将CO2通入0.1 mol·L-1的K2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=_________mol·L-1(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
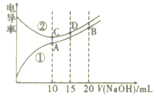
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含镁、氮、磷、砷等元素的化合物在化工生产、药物化学及催化化学等领域应用广泛。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)晶格能又叫点阵能。它是1mol 离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO 晶格能可通过如图所示的Borm Haber循环计算得到。
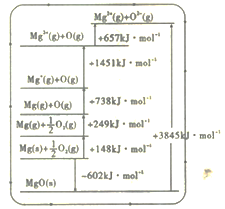
Mg的第二电离能为______kJ·mol-1;MgO的晶格能为___________kJ·mol-1。
(3)乙二胺(H2NCH2CH2NH2) 是一种有机化合物,其中N原子的杂化类型是____,该有机化合物能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______,其中与乙二胺形成的化合物稳定性相对较高的是_______(填 “Mg2+ ”或“Cu2+” )。
(4) PCl5是一种白色固体,加热到160°C不经过液态阶段就变成蒸气,测得180°C下的蒸气密度(折合成标准状况)为9.3g·L-1,分子的极性为零,P-Cl键长为204pm和211pm两种。在180°C下PCl5蒸气中存在的分子形式为____(填化学式),分子的空间构型为______,P、Cl的电负性由大到小顺序为________。
(5)砷和铟组成的一种化合物属于半导体材料,其晶胞结构如图所示。已知晶胞的参数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g. cm-3 (用含a和NA的代数式表示)。
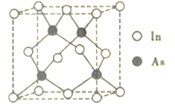
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硼、砷的化合物用途非常广泛。根据所学知识回答下列问题:
(1)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a、b、c、d、e对应元素电负性最大的是__(用元素符号表示),e点代表的第三周期某元素的基态原子核外电子占据的最高能层符号为__,该能层具有的原子轨道数为__。
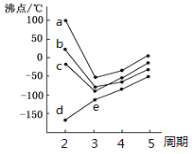
(2)已知反应:(CH3)3C-F+SbF5→(CH3)3CSbF6,该反应可生成(CH3)3C+,该离子中碳原子杂化方式有__。
(3)一种新型储氢化合物氨硼烷是乙烷的等电子体,且加热氨硼烷会慢慢释放氢气,推断氨硼烷的结构式为__(若含有配位键,要求用箭头表示)。
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为__;正四面体形阳离子中键角大于PCl3的键角原因为___。
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() )
)
①请在图中画出砷化硼晶胞的俯视图__。
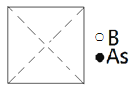
②与砷原子紧邻的硼原子有__个,与每个硼原子紧邻的硼原子有__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol/LKOH溶液中逐滴加入0.2mol/L甲酸(HCOOH,弱酸)溶液,溶液pH和加入甲酸的体积关系曲线如图所示,下列关系正确的是
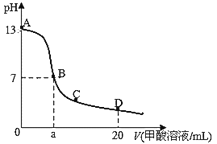
A.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B.在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C.B→C段:水的电离程度先增大后减小
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com