
【题目】下列不能减慢锌与稀盐酸的反应速率的措施是
A. 降低温度B. 加入氯化钠溶液
C. 加入少量CH3COONa固体D. 增大锌的用量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成![]() ,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
A. Na2S2O3只有还原性
B. 氧化产物与还原产物的物质的量之比为2∶1
C. 每生成1 mol Na2S2O3,转移4×6.02×1023个电子
D. 标准状况下,每吸收4 mol SO2就会放出22.4 L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。
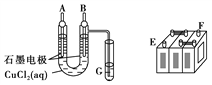
①若A接E,B接F,而B电极出现____________现象,电极反应式为_______________,则说明F为正极。
②铅蓄电池工作时(放电),其E所在电极的电极反应式为 ________,充电时该极与外接电源的________极相连。
③若有0.2 mol电子发生转移,则正极消耗的PbO2的物质的量是________。
(2)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极反应式为________________________________________________________________________
(3)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+,正极的反应式:_____________________________;电池反应的总方程式为____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是( )
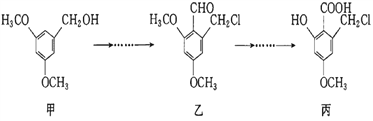
A. 乙、丙都能发生银镜反应
B. 可用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 乙、丙两种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

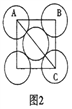
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH2=C(CH3)2和![]() 为原料可制备香料E(C11H12O2),其合成路线如下:
为原料可制备香料E(C11H12O2),其合成路线如下:
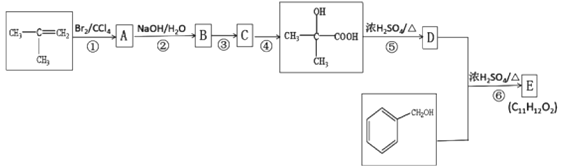
已知C 能发生银镜反应,D能使酸性高锰酸钾溶液褪色。请回答下列问题:
(1) 根据系统命名法有机物CH2=C(CH3)2的名称为___________;
(2) C 中能发生银镜反应的官能团名称是___________;
(3) ⑤的反应类型是_________;
(4) 写出⑥反应的化学方程式:__________________;
(5) 含苯环的![]() 的同分异构体有______种(不包含
的同分异构体有______种(不包含![]() ),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
(6) 参照上述合成路线设计一条由乙烯制备聚乙二酸乙二酯的合成路线(无需注明反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
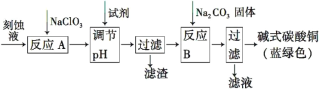
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com