
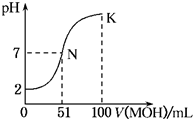
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:分析 (1)根据酸的浓度和溶液的PH判断酸的强弱;
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;写出M+离子水解的离子方程式;
(3)MA稀溶液氢离子全部由水电离;
(4)向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液100mL,则溶液中溶质为等物质的量的MA和MOH;
(5)根据电荷守恒和物料守恒进行计算.
解答 解:(1)根据图象知,0.01mol•L-1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸,
故答案为:强;0.01 mol•L-1HA的pH为2,说明HA完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O?MOH+H+;
故答案为:<;M++H2O?MOH+H+;
(3)MA稀溶液氢离子全部由水电离,则常温下一定浓度的MA稀溶液的pH=a,由水电离出的c(OH-)=1×10-amol•L-1;
故答案为:1×10-amol•L-1;
(4)向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液100mL,则溶液中溶质为等物质的量的MA和MOH,溶液显碱性,则溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+);
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(5)HA是强酸,所以反应后的溶液中,c(A-)=$\frac{1}{2}$×0.01mol•L-1=0.005mol•L-1,故c(M+)+c(MOH)=2c(A-);
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol•L-1≈0.005mol•L-1,
故答案为:=;0.005.
点评 本题考查了弱电解质的电离、盐类的水解、溶液的稀释、离子浓度的大小比较等知识点,利用电荷守恒、物料守恒来分析解答即可,难度中等,侧重于考查学生对基础知识的应用能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝 | 金属铁比铜活泼 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2═CO2 | B. | NH3+HCl═NH4Cl | ||
| C. | 2Fe(OH)3═Fe2O3+3H2O | D. | NaOH+HNO3═NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑥ | B. | ②③④⑤ | C. | ③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
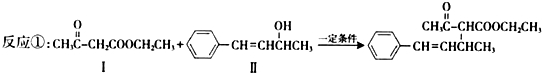
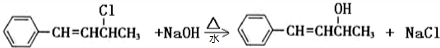 .
.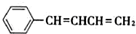 .
.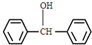 与
与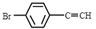 ,也可以发生类似反应①的反应,有机产物的结构简式为
,也可以发生类似反应①的反应,有机产物的结构简式为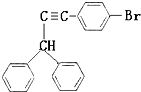 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2能使溴水褪色 | SO2具有还原性 |
| B | NH3能使酚酞溶液变红 | NH3可用于设计喷泉 |
| C | SiO2能与氢氟酸、碱反应 | SiO2是两性氧化物 |
| D | 晶体Si熔点高硬度大 | 晶体Si可用作半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从石油中获得乙烯,已成为目前工业上生产乙烯的主要途径 | |
| B. | 催化剂一般在金属与非金属的分界处寻找 | |
| C. | 硅是一种良好的导热、导电材料 | |
| D. | 氢的同位素${\;}_{1}^{1}$H可用于制造氢弹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com