
| A. | 加入一定量C,平衡逆向移动 | |
| B. | 保持温度不变,容器容积压缩到原来的一半,物质B的浓度变为原来的1.8倍,则平衡正向移动 | |
| C. | 恒温恒压,再充入1mol氦气(不参与反应),A的转化率增大,则m<n | |
| D. | 恒温恒压,再加入2mol的A,气体的平均相对分子质量变为原来的2倍 |
分析 A.固体量的多少不影响平衡移动;
B.保持温度不变,容器容积压缩到原来的一半,如果平衡不移动,则B浓度是原来2倍,实际上物质B的浓度变为原来的1.8倍,说明平衡逆向移动;
C.恒温恒压条件下,充入氦气,容器体积增大,A的转化率增大,说明平衡正向移动;
D.恒温恒压条件下,加入2molA,容器体积增大到原来2倍,达到平衡状态时各物质浓度与原来相同.
解答 解:A.C是固体,C物质的量的多少不影响平衡移动,故A错误;
B.保持温度不变,容器容积压缩到原来的一半,如果平衡不移动,则B浓度是原来2倍,实际上物质B的浓度变为原来的1.8倍,B的浓度减小说明平衡逆向移动,故B错误;
C.恒温恒压条件下,充入氦气,容器体积增大,压强减小,A的转化率增大,说明平衡正向移动,减小压强平衡向气体体积增大方向移动,所以m<n,故C正确;
D.恒温恒压条件下,加入2molA,容器体积增大到原来2倍,达到平衡状态时各物质浓度与原来相同,则气体的平均相对分子质量不变,故D错误;
故选C.
点评 本题考查化学平衡影响因素,为高频考点,明确改变容器体积时平衡如何移动是解本题关键,易错选项是D,注意D中加入2molA后,A的物质的量是原来2倍、容器体积也是原来2倍,为等效平衡,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用加热试管中的NH4Cl制取NH3 | |
| B. | 可用MnO2固体和稀盐酸共热制取Cl2 | |
| C. | 可用炽热的碳和浓硫酸反应制取SO2 | |
| D. | 可用铝箔和NaOH溶液反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.2NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断黄金首饰中是否掺有铜 | B. | 实验室制取二氧化碳 | ||
| C. | 除去镀在铝表面的铜镀层 | D. | 配制溶解金的王水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
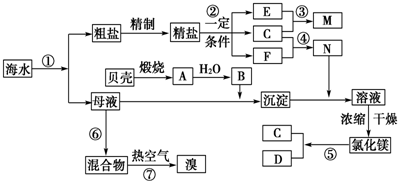 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com